2. 华东师范大学 上海市城市化生态过程与生态恢复重点实验室, 上海 200241
2. Shanghai Key Laboratory of Urbanization Ecological Restoration, East China Normal University, Shanghai 200241, China
随着黑臭河道整治工作的相继开展, 河道黑臭现象得到了有效控制, 但总氮去除率偏低问题逐渐凸显, 氮营养盐难以去除成为黑臭河道治理过程中亟待解决的突出问题.硫元素是河道生态系统的重要元素, 由于水体中硫化物的高度不稳定性, 其对氮素削减过程的影响作用往往被屏蔽.此外, 现阶段关于硫对反硝化作用的研究还存在分歧.一方面, 硫化物可能耦合硝酸盐还原过程, 促进硫自养反硝化的发生[1-2];另一方面, 高浓度的硫化物会通过抑制一氧化氮(NO)和一氧化二氮(N
本实验所需的河道底泥和上覆水均采集于上海市桃浦区里店浦, 该河为上海市工业河的一条支流, 受沿岸排污口影响不断纳入污水, 污染情况严重, 河水的水动力条件较差, 自净能力较弱, 是典型的城市黑臭河道.采样河道的位置如下图 1所示.
|
图 1 采样点地理位置图 Fig.1 Location of the Lidianpu River and the sampling sites |
里店浦底泥的基本理化性质:底泥酸可挥发硫化物(AVS)含量为122.7
将取回的底泥置于500 mL血清瓶中, 加入基础培养液和微量元素溶液[11], 河道底泥与液体培养基比例为1:10, 添加相应浓度的硫化物(Na
为探究不同硫化物浓度对自养反硝化的影响, 设置实验组1—5 (见表 1), 分别设置硫化物溶液为0、8、40、64和96 mg
| 表 1 不同培养实验组所添加基质 Tab. 1 ddition of substrates in each sediment incubation assays |
在培养期间, 定期取样测定NH
硫自养反硝化实验各组趋于稳定时, 将根据理化指标分析, 选取关键实验组中的底泥进行细菌通用引物和基于功能基因16S rDNA、nirS、dsrB的高通量测序分析及荧光定量PCR测定分析, 以解析底泥细菌、反硝化和硫酸盐还原菌群丰度及结构的响应变化.高通量测序与荧光定量测定所用引物如下表 2所示.
| 表 2 高通量测序及荧光定量所用引物 Tab. 2 Primers used in high-throughput sequencing and real-time PCR analysis |
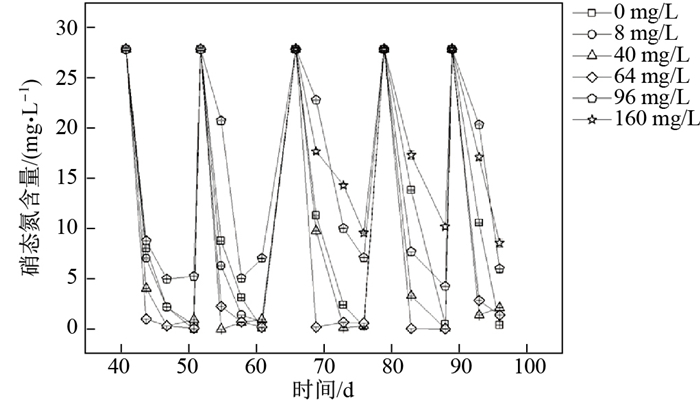
不同硫化物浓度对反硝化过程的影响不同.图 2是比较各实验组硝酸盐的浓度变化, 从图上直线的下降水平可以看出, 硫化物浓度为8 mg
|
图 2 不同硫化物浓度下底泥硝态氮含量变化 Fig.2 Change in concentrations of nitrate for sediment incubations with different sulfide concentrations |
| 表 3 培养周期内添加不同浓度硫化物的各底泥培养组中硝酸盐还原速率分析 Tab. 3 Assessment of nitrate reduction rate for sediment incubations with the addition of different sulfide concentrations over different time periods |
由此可见, 较低浓度的硫化物(S
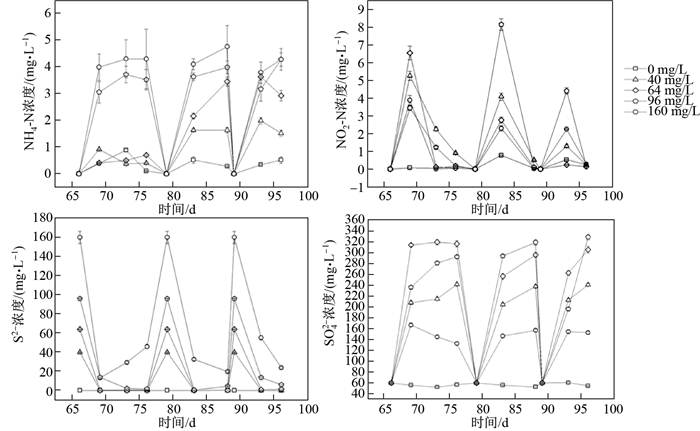
此外, 高浓度硫化物实验组后期出现较明显的氨氮积累(见图 3). S
|
图 3 不同硫化物浓度下底泥培养组各理化指标变化情况 Fig.3 Changes in physical and chemical indicators of sediment incubations with different sulfide concentrations |
不同硫化物浓度下各实验组硫化物和硫酸盐浓度变化有明显差异(见图 3).当S
本实验选取实验组3 (硫化物浓度为40 mg
借助于高通量及荧光定量PCR探究底泥培养实验组3的底泥中与氮硫代谢相关微生物的丰度与结构响应变化, 以期望进一步解析硫对底泥反硝化潜力的影响.
2.2.1 底泥氮硫代谢相关菌群结构的响应变化培养组底泥细菌多样性与对照组有明显差异(见表 4).实验组3(硫化物40 mg
| 表 4 反硝化培养组底泥样品细菌多样性信息统计 Tab. 4 Statistics for bacterial diversity in sediment from denitrification incubations |
根据底泥结构检测结果(见图 4), 反硝化培养组底泥细菌多样性以变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和嗜热丝菌门(Caldiserica)为主; 对照组底泥细菌以变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)和拟杆菌门(Bacteroidetes)为主.变形菌门(Proteobacteria)在实验组3和对照培养组底泥中的相对丰度分别为53.75%和28.31%;绿弯菌门(Chloroflexi)在各培养组底泥中的相对丰度分别为22.96%和37.45%;拟杆菌门(Bacteroidetes)在各培养组底泥中的相对丰度为13.21%和21.61%(见表 5).在为期近100 d的培养后, 实验组3底泥的变形菌门(Proteobacteria)远远高于对照培养组底泥, 分析可能是长时间反硝化潜力的培养使得底泥反硝化细菌(隶属于变形菌门)活性提高且数量增加, 而对照培养组培养过程中只添加了硫化物, 没有硝酸盐作为电子受体供反硝化细菌利用, 因此其反硝化细菌的活性相对较低.
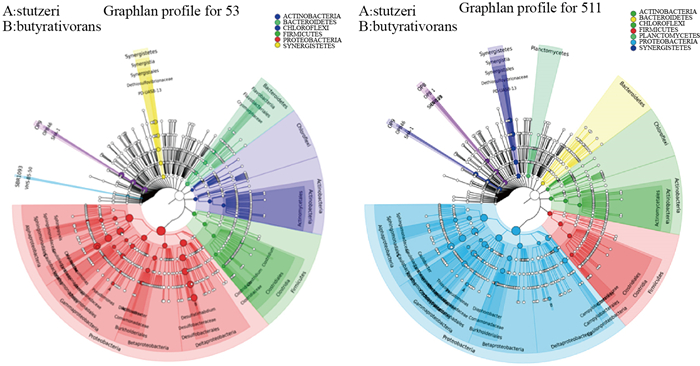
|
图 4 硫化物40 mg |
| 表 5 反硝化培养组底泥细菌门水平组成 Tab. 5 Composition of bacteria at the phylum level in sediment from denitrification-assessed |
基于功能基因nirS检测, 实验组3底泥的优势硫自养反硝化菌为硫杆菌属(Thiobacillus)与硫针菌属(Sulfuritalea)分别占21.5%与4.85%.对照培养组优势硫自养反硝化菌为硫杆菌属(Thiobacillus)与硫针菌属(Sulfuritalea), 分别占2.43%和0.80%.硫杆菌属(Thiobacillus)是最常见且研究最为广泛的硫自养反硝化菌[27].实验组3底泥中的硫杆菌属(Thiobacillus)的相对丰度(21.5%)远高于对照培养组, 表明该体系中硫自养反硝化活性很高, 与促进反硝化作用分析一致.另外, 帕氏氢噬胞菌(Hydrogenophaga)和苯基杆菌属(Phenylobacterium)在该培养组中相对丰度较高, 上述菌属的主要功能分别是多环芳烃的降解和石油烃及一些混合烃的降解, 推测是培养组中反硝化菌为自养细菌, 为其他降解有机物的细菌提供了更适宜的生成空间.对于反硝化细菌, 实验组3底泥中主要的反硝化细菌为假单胞菌属(Pseudomonas)与陶厄氏菌属(Thauera)分别占1.78%与14.3%;在只添加硫化物的对照培养组底泥中分别占2.38%和14.6%.实验组底泥的核心反硝化菌属为陶厄氏菌属(Thauera)、假单胞菌(Pseudomonas)、贪铜菌属(Cupriavidus)、丛毛单胞菌属(Comamonas)和副球菌(Paracoccus).
基于功能基因dsrB分析底泥硫酸盐还原菌可知:实验组3底泥中的硫酸盐还原菌主要为脱硫微菌属(Desulfomicrobium)与脱硫肠状菌属(Desulfotomaculum), 分别占0.56%与15.3%;在只添加硫化物的对照培养组底泥中分别占1.18%和5.65%.可以看出实验组脱硫肠状菌属含量明显小于对照培养组, 推测可能实验组反硝化作用得到促进, 反硝化细菌与硫酸盐还原菌竞争激烈, 不利于硫酸盐还原, 导致该菌属含量明显下降.
2.2.2 底泥氮硫代谢相关菌群丰度的响应变化在为期近100 d的培养后, 底泥细菌总数明显增加.实验组3中的细菌数量由初始的1.06
培养后的底泥反硝化细菌数量明显增加, 而硫酸盐还原菌数量有所下降.实验组3中的反硝化细菌数量由初始的1.58
| 表 6 反硝化底泥中氮硫代谢关键菌群丰度响应 Tab. 6 Statistics for bacterial diversity in sediment from denitrification incbuation |
本实验探究了硫化物对黑臭河道底泥反硝化作用潜势.当硫化物浓度控制在64 mg
实验结果表明当硫化物浓度控制在64 mg
| [1] |
朱艺双, 朱瑾, 何岩.城市黑臭河道内源硫与硝酸盐异化还原过程的耦合机制研究[C]//2017中国环境科学学会科学与技术年会论文集(第二卷), 2017.
|
| [2] |
SHAO M F, ZHANG T, FANG H H. Sulfur-driven autotrophic denitrification:Diversity, biochemistry, and engineering applications[J]. Applied Microbiology and Biotechnology, 2010, 88(5): 1027-1042. DOI:10.1007/s00253-010-2847-1 |
| [3] |
SENGA Y, MOCHIDA K, FUKUMORI R, et al. N2O accumulation in estuarine and coastal sediments:The influence of H2S on dissimilatory nitrate reduction[J]. Estuarine, Coastal and Shelf Science, 2006, 67(1/2): 231-238. |
| [4] |
BOWLES M W, NIGRO L M, TESKE A P, et al. Denitrification and environmental factors influencing nitrate removal in Guaymas Basin hydrothermally altered sediments[J]. Frontiers in Microbiology, 2012, 3(377): 1-11. |
| [5] |
汪建华.城市黑臭河道氮转化途径分型表征及微生物作用机理研究[D].上海: 华东师范大学, 2017.
|
| [6] |
PLUMMER P, TOBIAS C, CADY D. Nitrogen reduction pathways in estuarine sediments:Influences of organic carbon and sulfide[J]. Journal of Geophysical Research:Biogeosciences, 2015, 120(10): 1958-1972. DOI:10.1002/2015JG003057 |
| [7] |
MAHMOOD Q, ZHENG P, CAI J, et al. Anoxic sulfide biooxidation using nitrite as electron acceptor[J]. Journal of Hazardous Materials, 2007, 147(1/2): 249-256. |
| [8] |
AN S, GARDNER W S. Dissimilatory nitrate reduction to ammonium (DNRA) as a nitrogen link, versus denitrification as a sink in a shallow estuary (Laguna Madre/Baffin Bay, Texas[J]. Marine Ecology Progress Series, 2002, 237: 41-50. DOI:10.3354/meps237041 |
| [9] |
JUNCHER J C, JACOBSEN O S, ELBERLING B, et al. Microbial oxidation of pyrite coupled to nitrate reduction in anoxic groundwater sediment[J]. Environmental Science & Technology, 2009, 43(13): 4851-4857. |
| [10] |
SHAO M, ZHANG T, FANG H H. Sulfur-driven autotrophic denitrification:Diversity, biochemistry, and engineering applications[J]. Applied Microbiology and Biotechnology, 2010, 88(5): 1027-1042. DOI:10.1007/s00253-010-2847-1 |
| [11] |
DAPENA-MORA A, FERNÁNDEZ I, CAMPOS J L, et al. Evaluation of activity and inhibition effects on Anammox process by batch tests based on the nitrogen gas production[J]. Enzyme and Microbial Technology, 2007, 40(4): 859-865. DOI:10.1016/j.enzmictec.2006.06.018 |
| [12] |
邓旭亮, 王爱杰, 荣丽丽, 等. 硫自养反硝化技术研究现状与发展趋势[J]. 工业水处理, 2008(3): 13-16. DOI:10.3969/j.issn.1005-829X.2008.03.004 |
| [13] |
YANG X, HUANG S, WU Q. Nitrate reduction coupled with microbial oxidation of sulfide in river sediment[J]. Journal of Soils and Sediments, 2012, 12(9): 1435-1444. DOI:10.1007/s11368-012-0542-9 |
| [14] |
HAAIJER S C M, LAMERS L P M, SMOLDERS A J P, et al. Iron sulfide and pyrite as potential electron donors for microbial nitrate reduction in freshwater wetlands[J]. Geomicrobiology Journal, 2007, 24(5): 391-401. DOI:10.1080/01490450701436489 |
| [15] |
HAYAKAWA A, HATAKEYAMA M, ASANO R, et al. Nitrate reduction coupled with pyrite oxidation in the surface sediments of a sulfide-rich ecosystem[J]. Journal of Geophysical Research Biogeosciences, 2013, 118(2): 639-649. DOI:10.1002/jgrg.20060 |
| [16] |
张梦绯. 生态修复技术在治理城市黑臭河流的应用[J]. 污染防治术, 2017, 30(5): 59-61. |
| [17] |
李文超, 王琦, 石寒松, 等. 城市黑臭河道中硫、铁自养反硝化微生物研究[J]. 广东化工, 2017, 44(4): 77-78. DOI:10.3969/j.issn.1007-1865.2017.04.033 |
| [18] |
程庆霖, 何岩, 黄民生, 等. 城市黑臭河道治理方法的研究进展[J]. 上海化工, 2011, 36(2): 25-31. DOI:10.3969/j.issn.1004-017X.2011.02.007 |
| [19] |
李艳梅.硫自养反硝化细菌脱氮除硫性能研究[D].辽宁大连: 大连理工大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10141-1012394914.htm
|
| [20] |
SASS H, RAMAMOORTHY S, YARWOOD C, et al. Desulfovibrio idahonensis sp. nov., sulfate-reducing bacteria isolated from a metal (loid)-contaminated freshwater sediment[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(9): 2208-2214. DOI:10.1099/ijs.0.016709-0 |
| [21] |
HALLER L, TONOLLA M, ZOPFI J, et al. Composition of bacterial and archaeal communities in freshwater sediments with different contamination levels (Lake Geneva, Switzerland)[J]. Water Research, 2011, 45(3): 1213-1228. DOI:10.1016/j.watres.2010.11.018 |
| [22] |
MEYER B, KUEVER J. Molecular analysis of the distribution and phylogeny of dissimilatory adenosine-5'-phosphosulfate reductase-encoding genes (aprBA) among sulfur-oxidizing prokaryotes[J]. Microbiology, 2007, 153(10): 3478-3498. DOI:10.1099/mic.0.2007/008250-0 |
| [23] |
MEYER B, KUEVER J. Molecular Analysis of the diversity of sulfate-reducing and sulfur-oxidizing prokaryotes in the environment, using aprA as functional marker gene[J]. Applied and Environmental Microbiology, 2007, 73(23): 7664-7679. DOI:10.1128/AEM.01272-07 |
| [24] |
MEYER B, KUEVER J. Phylogeny of the alpha and beta subunits of the dissimilatory adenosine-5'-phosphosulfate (APS) reductase from sulfate-reducing prokaryotes-origin and evolution of the dissimilatory sulfate-reduction pathway[J]. Microbiology, 2007, 153(7): 2026-2044. DOI:10.1099/mic.0.2006/003152-0 |
| [25] |
PHILIPPOT L. Denitrifying genes in bacterial and Archaeal genomes[J]. B Biochimica et Biophysica Acta, 2002, 1577(3): 355-376. DOI:10.1016/S0167-4781(02)00420-7 |
| [26] |
孙韶玲.水体黑臭演化过程及挥发性硫化物的产生机制初步研究[D].山东烟台: 中国科学院烟台海岸带研究所, 2017. http://cdmd.cnki.com.cn/Article/CDMD-80180-1017811411.htm
|
| [27] |
YE W J, LIU X L, LIN S Q, et al. The vertical distribution of bacterial andarchaeal communities in the water and sediment of LakeTaihu[J]. FEMS Microbiology Ecology, 2009, 70: 263-276. DOI:10.1111/fem.2009.70.issue-2 |
| [28] |
PURCELL A M, MIKUCKI J A, ACHBERGER A M, et al. Microbial sulfur transformations in sediments from Subglacial Lake Whillans[J]. Frontiers in Microbiology, 2014, 5(594): 1-16. |
| [29] |
CARDOSO R B, SIERRA-ALVAREZ R, ROWLETTE P, et al. Sulfide oxidation under chemolithoautotrophic denitrifying conditions[J]. Biotechnology and Bioengineering, 2006, 95(6): 1148-1157. DOI:10.1002/(ISSN)1097-0290 |
| [30] |
FLANAGAN D A, GREGORY L G, CARTER J P, et al. Detection of genes for periplasmic nitrate reductase in nitrate respiring bacteria and in community DNA[J]. FEMS Microbiology Letter, 1999, 177(2): 263-270. DOI:10.1111/fml.1999.177.issue-2 |
| [31] |
ANGELONI N L, JANKOWSKI K J, TUCHMAN N C, et al. Effects of an invasive cattail species (Typha x glauca) on sediment nitrogen and microbial community composition in a freshwater wetland[J]. FEMS Microbiology Letters, 2006, 263(1): 86-92. DOI:10.1111/fml.2006.263.issue-1 |
| [32] |
BRAKER G, TIEDJE J M. Nitric oxide reductase (norB) genes from pure cultures and environmental samples[J]. Applied and Environmental Microbiology, 2003, 69(6): 3476-3483. DOI:10.1128/AEM.69.6.3476-3483.2003 |
| [33] |
ANGELONI N L, JANKOWSKI K J, TUCHMAN N C, et al. Effects of an invasive cattail species (Typha x glauca) on sediment nitrogen and microbial community composition in a freshwater wetland[J]. FEMS Microbiology Letters, 2006, 263(1): 86-92. DOI:10.1111/fml.2006.263.issue-1 |
| [34] |
BIDERRE-PETIT C, BOUCHER D, KUEVER J, et al. Identification of sulfur-cycle prokaryotes in a low-sulfate lake (Lake Pavin) using aprA and 16S rRNA gene markers[J]. Microbial Ecology, 2011, 61(2): 313-327. |
| [35] |
WATANABE T, KOJIMA H, FUKUI M. Identity of major sulfur-cycle prokaryotes in freshwater lake ecosystems revealed by a comprehensive phylogenetic study of the dissimilatory adenylylsulfate reductase[J]. Scientific Reports, 2016, 6(1): 1-9. DOI:10.1038/s41598-016-0001-8 |
| [36] |
WATANABE T, KOJIMA H, TAKANO Y, et al. Diversity of sulfur-cycle prokaryotes in freshwater lake sediments investigated using aprA as the functional marker gene[J]. Systematic and Applied Microbiology, 2013, 36(6): 436-443. DOI:10.1016/j.syapm.2013.04.009 |
| [37] |
KOJIMA H, FUKUI M. Sulfuricella denitrificans gen. nov., sp. nov., a sulfur-oxidizing autotroph isolated from a freshwater lake[J]. I International Journal of Systematic and Evolutionary Microbiology, 2010, 60(12): 2862-2866. DOI:10.1099/ijs.0.016980-0 |
| [38] |
SHAO M, ZHANG T, FANG H H. Sulfur-driven autotrophic denitrification:diversity, biochemistry, and engineering applications[J]. Applied Microbiology and Biotechnology, 2010, 88(5): 1027-1042. DOI:10.1007/s00253-010-2847-1 |
| [39] |
KOJIMA H, WATANABE T, IWATA T, et al. Identification of major planktonic sulfur oxidizers in stratified freshwater Lake[J]. Plos One, 2014, 9(4): 1-7. |
| [40] |
BISOGNI J J, DRISCOLL C T. Denitrification Using Thiosulfate and Sulfide[J]. J Env Eng Div, 1997, 103(4): 593-604. |
| [41] |
RIOS-DEL TORO E E, CERVANTES F J. Coupling between anammox and autotrophic denitrification for simultaneous removal of ammonium and sulfide by enriched marine sediments[J]. Biodegradation, 2016, 27(2/3): 107-118. |
| [42] |
REYES-AVILLA J, RAZO-FLORE E, GOMEZ J. Simultaneous biological removal of nitrogen, carbon and sulfur by denitrification[J]. Water Research, 2004, 38(14/15): 3313-3321. |
| [43] |
王爱杰, 杜大仲, 任南琪. 脱氮硫杆菌在废水脱硫、脱氮处理工艺中的应用[J]. 哈尔滨工业大学学报, 2004, 36(4): 423-425. DOI:10.3321/j.issn:0367-6234.2004.04.003 |
| [44] |
ZHANG S Y, ZHOU Q H, XU D, et al. Effects of sediment dredging on water quality and zooplankton community structure in a shallow of eutrophic lake[J]. Journal of Environmental Sciences, 2010, 22(2): 218-224. DOI:10.1016/S1001-0742(09)60096-6 |
| [45] |
李志洪.曝气扰动模式对黑臭河道底泥内源营养盐行为的影响作用及氮转化功能菌群响应规律研究[D].上海: 华东师范大学, 2015: 8-14. http://cdmd.cnki.com.cn/Article/CDMD-10269-1015339420.htm
|




