三苯基锡 (TPT) 属于典型的有机锡化合物, 自1960年以来被广泛用于农业杀菌剂, 也被添加在以三丁基锡 (TBT) 为主的海洋防污漆中[1]. TPT主要由农田通过径流进入海洋, 淡水中的TPT含量相对较高, 如在美国北卡罗莱纳州的Flat River检测到的TPT平均水平达到6.0
TPT极强的疏水性使其难以被微生物降解, 在生态系统中的半衰期由几周至几年不等[7].但其与一些氨基酸、多肽及蛋白质有很高的亲和力, 在生物体中具有很高的生物富集系数.母体中富集的TPT还能转移进下一代的胚胎中.如在野生中华鲟胚胎中检测到7.8 53.5 ng TPT/g (湿重) 的含量, 且胚胎的TPT含量高低与其母体年龄呈正相关关系[8].由此, TPT可以直接从母体转入胚胎, 从胚胎的发育之初就开始发挥影响.显微注射作为评价化合物毒性的一个强有力工具, 也能很好地模拟“母体-卵”这样一个毒素转移过程[9-10].
过氧化物酶体增殖体激活受体
本文通过显微注射探究了TPT、罗格列酮 (Rosi, Rosiglitazone, PPAR
显微注射系统 (包括拉针仪PC-10, 显微注射仪IM-9B, 注射器SYR-15, 显微操作仪M-152, 玻璃管G-1) 购自Narishige (日本).分子杂交仪 (HL-2000 HybriLinker) 购自UVP (美国). Zeiss V8体视显微镜购自Carl Zeiss MicroImaging GmbH (德国). 3-30K高速台式冷冻离心机购自Sigma (美国), MyCycler普通PCR仪购自Bio-rad (美国), 7500荧光定量PCR仪购自ABI (美国).氯化三苯基锡 (Triphenyltin chloride; 纯度为95%; CAS: 639-58-7), 罗格列酮 (Rosiglitazone, 纯度
挑选3对以上发育状态良好的性成熟热带爪蟾, 分两步注射hCG诱导抱对产卵.第一步每只成蛙注射20个单位hCG. 24 48 h后进行第二次注射, 每只成蛙注射100个单位hCG.之后将雌雄蛙两两配对置于水箱.产卵后, 利用现配的2% L-Cystein溶液 (pH=7.8) 收集胚胎并对其去膜, 至胚胎与胚胎之间的间隙较小时, 用0.1
TPT、Rosi及T0070907均利用DMSO助溶, 之后用无菌水稀释至注射所需浓度.注射液中DMSO的最高剂量不超过10%.将挑选出的S1-S2期的胚胎置于盛满6% Ficoll溶液 (50 mL配方: 3 g聚蔗糖粉末溶于0.1
培养中的胚胎分3种情况收集. ① 用于观察表型的胚胎培养至S40期左右收集, 用75%乙醇固定1 d后拍照; ② 用于检测头、眼部标志基因的胚胎在S20期及S25期收集.用于整胚原位杂交的胚胎收集于MEMFA固定液 (10 mL配方: 1 mol/L 3-(N-吗啡啉) 丙磺酸1 mL, 20 mmol/L乙二醇二乙醚二胺四乙酸1 mL, 10 mmol/L硫酸镁1 mL, 37%甲醛1 mL, 纯水定容至10 mL) 中固定2 h之后转移至甲醇中-20℃保存; ③ 用于反转录定量PCR的胚胎在达到S20期及S25期时收集于RNA Later中.其中, 每个化合物每个剂量组注射30只胚胎, 注射3次作为平行实验用于后续存活率及表型分析; 整胚原位杂交实验每个剂量组为12只受试胚胎; 反转录定量PCR中每个剂量组含3个平行, 一个平行为20只胚胎.
1.4 畸形的观察与分析将胚胎置于体视镜下进行发育状况和畸形表型的观察, 并使用Axiocam ICc3型显微照相系统拍照, 保存照片并用于后续分析.结果分析主要包括统计存活率及体长, 并根据爪蟾胚胎畸形级数分析系统统计畸形级数[13].胚胎的体长用软件ACDSee 10进行测量[14].畸形级数分析中, 每个注射组中随机取5个胚胎进行分析, 以其平均值作为该组相应指标的值.其中, 只有存活的胚胎用于体长及畸形数据的统计分析.
1.5 整胚原位杂交整胚原位杂交总过程涵盖5 d, 主要包括水化、消化及重固定胚胎; 胚胎与杂交液预杂交及与相应探针杂交液杂交; 利用封闭液封闭非特异性位点; 用含地高辛抗体的封闭液孵育胚胎; 用马来酸洗去背景信号; AP buffer洗涤并用BM purple显色; 胚胎的重固定及漂白; 最后胚胎于1
| 表 1 热带爪蟾头眼部标志基因定量PCR引物序列表 Tab.1 Oligonucleotide primers for real-time RT-PCR analysis of marker genes in Xenopus tropicalis |
首先, 利用RNeasy® Mini Kit对胚胎的总RNA进行抽提, 之后利用PrimeScript
定量PCR实验数据采用
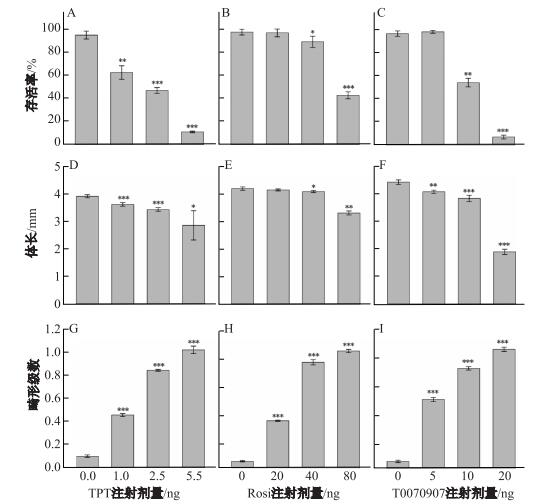
胚胎到达S40期时, 各对照组的存活率均
|
注:各标准差均由3次平行实验结果得出; 暴露组与对照组相比* |
就体长而言, 各注射组与对照组相比均有一定程度的减小. 5 ng TPT注射组与对照相比减少了27%, 80 ng Ros i注射组减少了22%, 20 ng T0070907注射组减少了57%(见图 1D-F).
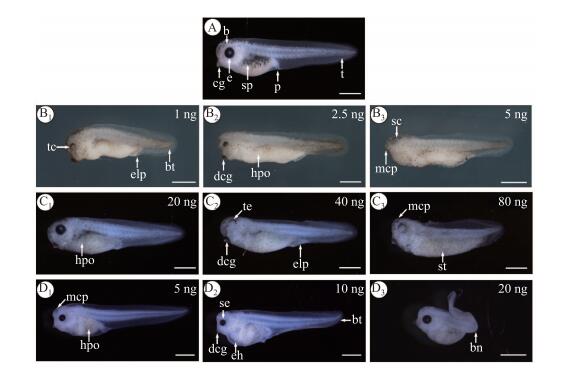
2.2 对胚胎的致畸效应及致畸强度胚胎到达S40期时, 对照组整体正常, 头部浑圆, 眼睛成圆形, 躯干上分布星状色素, 尾平直, 鳍平展 (见图 2A). TPT注射组与对照相比, 出现多种畸形现象, 如:发育迟缓、色素减少、脊柱弯曲、尾部弯曲、唾液腺下移和泄殖腔畸形, 最为明显的为小头畸形及眼睛变小 (见图 2B). Rosi注射组与对照相比, 出现晶状体浑浊、色素减少、泄殖腔膨大、躯干拉长和小头畸形 (见图 2C). T0070907注射组出现小头畸形、眼睛变小、围心腔水肿、尾巴弯曲、脊柱弯曲和色素减少 (见图 2D).
|
注: b头, bn脊柱弯曲, bt尾部弯曲, dcg唾液腺下移, e眼, eg唾液腺, eh围心腔水肿, elp泄殖腔膨大, hpo色素减少, mcp小头畸形, p泄殖腔, sp皮肤色素, st躯干拉长, t尾, te晶状体浑浊; 标尺=0.5 mm 图 2 TPT、Rosi及T0070907内暴露对热带爪蟾胚胎的致畸效应 Fig.2 Teratogenic effects of TPT, Rosi and T0070907 in ovo exposure on Xenopus tropicalis embryos |
通过畸形级数分析系统将胚胎的畸形程度量化后发现, 对照组胚胎的畸形级数均在0.1以下.胚胎的畸形级数随着每种化合物的剂量升高而升高.其中最高剂量的TPT (5 ng)、Rosi (80 ng) 和T0070907 (20 ng) 的平均畸形级数非常相近, 分别为1.02, 1.01和1.03 (见图 1G-I).
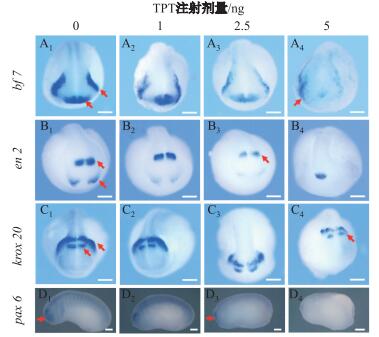
2.3 三苯基锡对胚胎头、眼标志基因表达的影响对照组胚胎bf1、en2、krox20及pax6的表达均丰富且对称 (见图 3A1-D1), 与该时期发育正常的热带爪蟾胚胎表达一致[16].前脑标志基因bf1杂交信号在处理组胚胎中位置弥散且信号随TPT剂量增大而变弱 (见图 3A2-4); 中脑标志基因en2随TPT剂量增大而变弱, 在5 ng注射组中部分胚胎还出现仅一处信号 (见图 3B2-4); 后脑标志基因krox20的表达位置变化不大, 但表达量随TPT剂量增大而变弱 (见图 3C2-4); 眼睛标志基因pax6的表达信号随TPT剂量增大而逐渐变弱且区域变小, 5 ng注射组部分胚胎未检测到表达信号 (见图 3D2-4).
|
注:红色箭头所示蓝紫色区域为整胚原位杂交信号; bf1, en2, krox20, pax6分别为热带爪蟾前脑、中脑、后脑、眼睛的标志基因; A-C组胚胎为S20期, 照片为背面观; D组胚胎为S25期, 照片为侧面观 图 3 TPT内暴露对热带爪蟾胚胎头部及眼部标志基因表达的影响 Fig.3 Effects of TPT in ovo exposure on brain and eye marker genes expression in Xenopus tropicalis embryos |
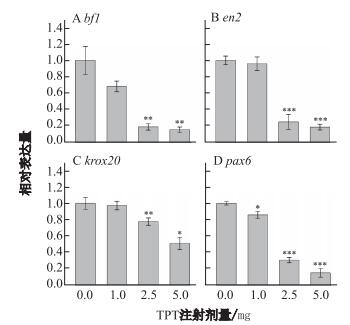
定量PCR表明, 在1 ng TPT注射组中3个脑部标志基因的表达量均没有显著性差异, 但在2.5 ng及5 ng TPT注射组, 表达量随剂量增大而减少. 5 ng组中, bf1的相对表达量降低了84%, en2降低了81%, krox20降低了49%(见图 4A-C).眼睛标志基因pax6在所有注射组都受到显著影响, 相对表达量在3个注射组分别降低了14%、69%及85%(见图 4D).
|
注:各标准差均由3次平行实验结果计算得出; 暴露组与对照组相比* |
在经典的爪蟾胚胎致畸实验 (FETAX, The Frog Embryo Teratogenesis Assay-Xenopus) 中化合物的暴露始于囊胚期晚期, TPT对热带爪蟾胚胎引起的主要畸形表型为:鳍变窄至消失, 且TPT的敏感阶段处于S32-S46阶段[6].本文利用显微注射使化合物的暴露开始于胚胎的发育起点, 发现TPT对热带爪蟾胚胎的鳍影响并不大, 主要畸形部位为头部及眼睛.这表明在同一物种中, 化合物的作用时期不同, 所致的毒性效应也存在不同.这可能是由于各组织器官的分化、形成时期具有时间特异性所致[17].在西伯利亚鲟 (Acipenser baerii) 胚胎中, 显微注射27 681 ng TPT/g (湿重) 也使得胚胎出现了小眼及无眼的畸形现象, 这与本文的结果一致.而在西伯利亚鲟胚胎中并未出现小头畸形, 出现的骨骼畸形 (脊柱弯曲) 在热带爪蟾胚胎中也并不明显[8].这表明了同一化合物对不同物种作用的相似性及差异性.
另一方面, 溶液 (外) 暴露实验模拟了施用过含TPT杀菌剂的农田及附近径流对胚胎的生长状况的影响, 本文的显微注射 (内) 暴露实验模拟了由“母体-卵”这一路径迁移的TPT对两栖类胚胎的影响.这两种实验方法在研究TPT对胚胎的致畸效应时存在互补关系.显微注射作为评价化合物毒性的有力工具, 在胚胎毒理学中也得到了一些学者的应用及推荐[18-20].
3.2 TPT对胚胎头、眼部标志基因的影响bf1(forkhead box G1), en2(engrailed homeobox 2), krox20(early growth response 2) 及pax6(paired box 6) 分别是典型的前脑、中脑、后脑及眼睛区域的标志基因, 被大量研究者用于爪蟾胚胎学的研究[21-23].本文中整胚原位杂交实验表明TPT降低了S20期 (神经胚期) 或S25期 (早期尾牙期) 胚胎中前脑、中脑、后脑及眼睛标志基因的表达.这进一步发展为S40期时观察到的小头畸形及小眼畸形.这与实验室前期研究中提出的TPT对热带爪蟾胚胎的致畸敏感阶段为S32-S46 (晚期尾牙期至蝌蚪期)[14]截然不同.整胚原位杂交实验证实了TPT在神经胚以前就开始影响胚胎.也暗示着胚胎的胶膜及卵膜在早期阻止了TPT的进入, 进而保护了胚胎.
整胚原位杂交使得研究者能清晰地看到所关注基因的在体空间表达, 在胚胎毒理学的研究中受到广泛使用[24-25].本文也表明标志基因的整胚原位杂交使得在各器官发育成形之前, 就能清楚地观察到其区域, 十分便于讨论污染物的早期发育毒性, 以及利用发育生物学的思路及技术手段探索化合物对胚胎的致畸机制.
3.3 TPT致畸与PPARPPAR
本实验中, PPAR
本文通过显微注射在热带爪蟾中模拟了TPT由“母体-卵”这一转移过程, 发现TPT能显著降低胚胎的存活率, 并能导致早期胚胎头部及眼睛变小甚至消失的畸形.指出了环境中生物母体富集的TPT对后代的潜在危害.另一方面, PPAR
| [1] | YI A X, LEUNG K M Y, LAM M H W, et al. Review of measured concentrations of triphenyltin compounds in marine ecosystems and meta-analysis of their risks to humans and the environment[J]. Chemosphere, 2012, 89(9): 1015-1025. DOI:10.1016/j.chemosphere.2012.05.080 |
| [2] | JONES-LEPP T L, VARNER K E, HEGGEM D. Monitoring dibutyltin and triphenyltin in fresh waters and fish in the United States using micro-liquid chromatorgraphy-electrospray/ion trap mass spectrometry[J]. Arch Environ Con Tox, 2004, 46(1): 90-95. DOI:10.1007/s00244-003-2286-4 |
| [3] | LARANJEIRO F, SANCHEZ-MARIN P, BARROS A, et al. Triphenyltin induces imposex in Nucella lapillus through an aphallic route[J]. Aquat Toxicol, 2016, 175: 127-131. DOI:10.1016/j.aquatox.2016.03.005 |
| [4] | DIMITRIOU P, CASTRITSI J. Acute toxicity effects of tributyltin chloride and triphenyltin chloride on gilthead seabream, Sparus aurata L, embryos[J]. Ecotox Environ Safe, 2003, 54(1): 30-35. DOI:10.1016/S0147-6513(02)00008-8 |
| [5] | SHI H, ZHU P, SUN Z, et al. Divergent teratogenicity of agonists of retinoid X receptors in embryos of zebrafish (Danio rerio)[J]. Ecotoxicology, 2012, 21(5): 1465-1475. DOI:10.1007/s10646-012-0900-9 |
| [6] | YU L, ZHANG X, YUAN J, et al. Teratogenic effects of triphenyltin on embryos of amphibian (Xenopus tropicalis):A phenotypic comparison with the retinoid X and retinoic acid receptor ligands[J]. J Hazard Mater, 2011, 192(3): 1860-1868. DOI:10.1016/j.jhazmat.2011.07.027 |
| [7] | GUDHMUNDSDOTTIR L O, HO K K Y, LAM J C W, et al. Long-term temporal trends (1992-2008) of imposex status associated with organotin contamination in the dogwhelk Nucella lapillus along the Icelandic coast[J]. Mar Pollut Bull, 2011, 63(5): 500-507. |
| [8] | HU J, ZHANG Z, WEI Q, et al. Malformations of the endangered Chinese sturgeon, Acipenser sinensis, and its causal agent[J]. P Natl Acad Sci USA, 2009, 106(23): 9339-9344. DOI:10.1073/pnas.0809434106 |
| [9] | NASSEF M, KIM S G, SEKI M, et al. In ovo nanoinjection of triclosan, diclofenac and carbamazepine affects embryonic development of medaka fish (Oryzias latipes)[J]. Chemosphere, 2010, 79(9): 966-973. DOI:10.1016/j.chemosphere.2010.02.002 |
| [10] | COLMAN J R, TWINER M J, HESS P, et al. Teratogenic effects of azaspiracid-1 identified by microinjection of Japanese medaka (Oryzias latipes) embryos[J]. Toxicon, 2005, 45(7): 881-890. DOI:10.1016/j.toxicon.2005.02.014 |
| [11] | GRUN F, WATANABE H, ZAMANIAN Z, et al. Endocrine-disrupting organotin compounds are potent inducers of adipogenesis in vertebrates[J]. Mol Endocrinal, 2006, 20(9): 2141-2155. DOI:10.1210/me.2005-0367 |
| [12] | HIGLEY E, TOMPSETT A R, GIESY J P, et al. Effects of triphenyltin on growth and development of the wood frog (Lithobates sylvaticus)[J]. Aquat Toxicol, 2013, 144: 155-161. |
| [13] | HU L, ZHU J, ROTCHELL J M, et al. Use of the enhanced frog embryo teratogenesis assay-Xenopus (FETAX) to determine chemically-induced phenotypic effects[J]. Sci Total Environ, 2015, 508: 258-265. DOI:10.1016/j.scitotenv.2014.11.086 |
| [14] | YUAN J, ZHANG X L, YU L, et al. Stage-specific malformations and phenotypic changes induced in embryos of amphibian (Xenopus tropicalis) by triphenyltin[J]. Ecotoxicol Environ Saf, 2011, 74(7): 1960-1966. DOI:10.1016/j.ecoenv.2011.07.020 |
| [15] | TANIBE M, ISHIURA S I, ASASHIMA M, et al. xCOUP-TF-B regulates xCyp26 transcription and modulates retinoic acid signaling for anterior neural patterning in Xenopus[J]. Int J Dev Biol, 2012, 56(4): 239-244. DOI:10.1387/ijdb.113482mt |
| [16] | XENBASE. 爪蟾联盟数据库[DB/OL]. [2016-03-20]. http:www.xenbase.org. |
| [17] | GONZALEZ-DONCEL M, FERNANDEZ-TORIJA C, HINTON D E, et al. Stage-specific toxicity of cypermethrin to medaka (Oryzias latipes) eggs and embryos using a refined methodology for an in vitro fertilization bioassay[J]. Arch Environ Con Tox, 2004, 48(1): 87-98. DOI:10.1007/s00244-003-0223-1 |
| [18] | HANO T, OSHIMA Y, OE T, et al. Quantitative bio-imaging analysis for evaluation of sexual differentiation in germ cells of olvas-GFP/ST-Ⅱ YI Medaka (Oryzias Latipes) nanoinjected in ovo with ethinylestradiol[J]. Environ Toxicol Chem, 2005, 24(1): 70-77. DOI:10.1897/03-610.1 |
| [19] | NASSEF M, SANG G K, SEKI M, et al. In ovo nanoinjection of triclosan, diclofenac and carbamazepine affects embryonic development of medaka fish (Oryzias latipes)[J]. Chemosphere, 2010, 79(9): 966-973. DOI:10.1016/j.chemosphere.2010.02.002 |
| [20] | COLMAN J R, TWINER M J, HESS P, et al. Teratogenic effects of azaspiracid-1 identified by microinjection of Japanese medaka (Oryzias latipes) embryos[J]. Toxicon, 2005, 45(7): 881-890. DOI:10.1016/j.toxicon.2005.02.014 |
| [21] | ERMAKOVA G V, SOLOVIEVA E A, MARTYNOVA N Y, et al. The homeodomain factor Xanf represses expression of genes in the presumptive rostral forebrain that specify more caudal brain regions[J]. Dev Biol, 2007, 307(2): 483-497. DOI:10.1016/j.ydbio.2007.03.524 |
| [22] | RODRIGUEZ-SEGUEL E, ALARCON P, GOMEZ-SKARMETA J L. The Xenopus Irx genes are essential for neural patterning and define the border between prethalamus and thalamus through mutual antagonism with the anterior repressors Fezf and Arx[J]. Dev Biol, 2009, 329(2): 258-268. DOI:10.1016/j.ydbio.2009.02.028 |
| [23] | WEI S, XU G, BRIDGES L C, et al. Roles of ADAM13-regulated Wnt activity in early Xenopus eye development[J]. Dev Biol, 2012, 363(1): 147-154. DOI:10.1016/j.ydbio.2011.12.031 |
| [24] | DONG W, MACAULAY L J, KWOK K W H, et al. Using whole mount in situ hybridization to examine thyroid hormone deiodinase expression in embryonic and larval zebrafish:a tool for examining OH-BDE toxicity to early life stages[J]. Aquat Toxicol, 2013, 132: 190-199. |
| [25] | TERAOKA H, DONG W, OGAWA S, et al. 2, 3, 7, 8-Tetrachlorodibenzo-p-dioxin toxicity in the zebrafish embryo:Altered regional blood flow and impaired lower jaw development[J]. Toxicol Sci, 2002, 65(2): 192-199. DOI:10.1093/toxsci/65.2.192 |
| [26] | TONTONOZ P, SPIEGELMAN B M. Fat and beyond:The diverse biology of PPARγ[J]. Annu Rev Biochem, 2008, 77: 289-312. DOI:10.1146/annurev.biochem.77.061307.091829 |
| [27] | EVANS R M, BARISH G D, WANG Y X. PPARs and the complex journey to obesity[J]. Nat Med, 2004, 10(4): 355-361. DOI:10.1038/nm1025 |
| [28] | KOSTADINOVA R, WAHLI W, MICHALIK L. PPARs in diseases:Control mechanisms of inflammation[J]. Curr Med Chem, 2005, 12(25): 2995-3009. DOI:10.2174/092986705774462905 |
| [29] | RICOTE M, GLASS C K. PPARs and molecular mechanisms of transrepression[J]. Biochimica et Biophysica Acta, 2007, 1771(8): 926-35. DOI:10.1016/j.bbalip.2007.02.013 |
| [30] | BONFANTI P, COLOMBO A, ORSI F, et al. Comparative teratogenicity of chlorpyrifos and malathion on Xenopus laevis development[J]. Aquat Toxicol, 2004, 70(3): 189-200. DOI:10.1016/j.aquatox.2004.09.007 |
| [31] | SAKA M. Developmental toxicity of p, p'-dichlorodiphenyltrichloroethane, 2, 4, 6-trinitrotoluene, their metabolites, and benzo[J]. Environ Toxicol Chem, 2004, 23(4): 1065-1073. DOI:10.1897/03-272 |
| [32] | ZHANG S, GU H, HU N. Role of peroxisome proliferator-activated receptor γ in ocular diseases[J]. J Ophthalmol, 2015, 2015: 1-10. |
| [33] | KASTNER P, GRONDONA J M, MARK M, et al. Genetic analysis of RXR alpha developmental function:Convergence of RXR and RAR signaling pathways in heart and eye morphogenesis[J]. Cell, 1994, 78(6): 987-1003. DOI:10.1016/0092-8674(94)90274-7 |




