2. 华东师范大学 上海市城市化生态过程与生态恢复重点实验室, 上海 200241
2. Shanghai Key Laboratory for Urban Ecological Processes and Eco-Restoration, East China Normal University, Shanghai 200241, China
氮素在地表水体中的过量积累已造成我国部分重点保护湖泊和水库的水体富营养化[1], 而地表水体中氮素积累的重要原因之一是城镇生活污水厂尾水的过量氮排放[2].为此, 《国务院关于印发水污染防治行动计划的通知》(国发[2015]17号)要求敏感湖库流域的城镇污水处理设施应于2017年年底前完成提标改造, 尾水水质达到一级A排放标准[3], 这无疑对我国城镇污水厂提标改造提出了更高要求.据报道, 通过对2013年全国11座城市122家污水厂尾水的NH4+-N和TN浓度监测发现, 约1/3的污水厂尾水TN浓度以及约1/6的污水厂尾水NH4+-N浓度未能满足一级A排放标准[4].污水厂进水缺乏碳源造成的反硝化不足以及低温条件引起的硝化和反硝化效率下降是现有城镇生活污水厂尾水NH4+-N及TN浓度不达标的主要原因[5-7].因此亟需对我国城镇生活污水厂提标改造过程中的脱氮效率进行强化.
为有效解决上述问题, 本研究研发了一种新型原位强化脱氮装置——管式生物净水装置(Tubular bio-reactor device, TBD)[8]. TBD以现有城镇生活污水厂尾水的受纳水体作为实施空间进行原位净化, 并综合利用其内部填充基质的物理过滤、化学吸附和微生物生化作用以及TBD上栽培植物的吸收作用实现污水的强化脱氮.用于城镇生活污水厂提标改造的传统强化脱氮工艺(如反硝化生物滤池、人工湿地和生态浮床等)中填充基质的吸附、挂膜及释碳特性对于脱氮效果存在显著影响[9-11].丝瓜络可作为生物膜反应器及反硝化生物滤池的填充基质, 对污水具有良好的脱氮除磷效果[12-13]; 棕丝作为一种常见天然介质材料, 对富营养化水体的净化效果显著[14]; 甘蔗渣因其良好的释碳性能, 被证明是强化脱氮的理想材料[15-16]; 而化学纤维填料具有较低的液体阻力、较大比表面积和容积负荷, 并被实践证实具有良好的促进生物硝化和反硝化的作用[17].另外, 生菜作为常见蔬菜品种因具有营养丰富、用途广泛、产率较高等特点, 符合典型生态修复措施中“植物应具有广泛用途或经济价值高”的选择应用原则[18-19].
因此, 本研究选取丝瓜络、棕丝、甘蔗渣及化学纤维填料等4种固体材料分别作为TBD的填充基质, 并选取生菜作为其栽培植物, 通过对比不同基质类型的TBD对城镇生活污水厂尾水的强化脱氮性能, 得出其最佳填充基质, 并结合基质生物膜的高通量测序结果解析其脱氮机理, 以期为该装置服务于城镇生活污水厂提标改造的工程化应用提供依据和参数.
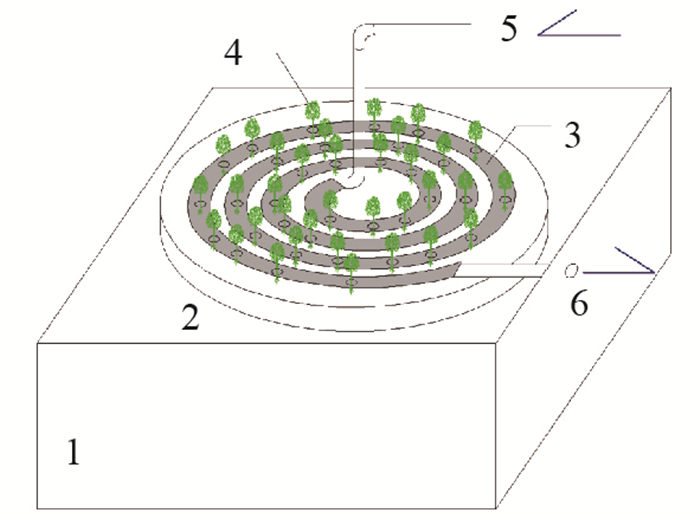
1 材料与方法 1.1 试验装置与运行条件本试验于2015年5月初开展, 试验设置了4组平行的小试规模的TBD, 其构造如图 1所示. 4组TBD分别放置于4个相同的水槽中, 水槽中的水体仅为管式生物净水装置提供浮力, 而与TBD内部的水体无交换.每组TBD均由净水生物盘管、浮体、植物及进水口、出水口组成.净水生物盘管均由长度12 m、直径7.6 cm、厚度0.3 mm的PE吹塑软管和管内填充基质构成, 其被盘绕成盘状(直径约65 cm)并固定于浮体上.在盘绕成型的净水生物盘管上方均匀分布36个直径1 cm的植物种植孔, 植物选用生菜并通过播种方式将生菜种子种植于净水生物盘管的基质中. TBD的进水通过蠕动泵匀速泵入净水生物盘管的进水口, 出水通过水槽上的出水口排出. 4组管式生物净水装置的管式生物反应器内分别填充:丝瓜络、棕丝、甘蔗渣和化学纤维填料, 其对应编号分别为T1、T2、T3、T4. T1—T4所填充填料的填充率均为33%. T1—T4所填充填料的含水率、密度、COD
|
注: 1水槽, 2浮体, 3净水生物盘管, 4植物, 5进水口, 6出水口 图 1 TBD构造 Fig.1 The structure of a TBD |
| 表 1 T1—T4所填充填料的基本理化性质 Tab.1 Basic physical and chemical properties of the fillers in T1—T4 |
表 1中填料的COD
TBD的进水流量(
依据上述设计及运行参数, TBD拟用于城镇生活污水厂尾水的原位强化脱氮, 其实际应用方法如下. TBD主要由净水生物盘管、集水槽、浮体及植物组成; TBD设置于城镇生物污水厂尾水受纳水体中; 净水生物盘管设置于浮体上, 浮体漂浮于水面.将污水厂尾水以“重力自流”的方式收集于TBD的集水槽中, 集水槽的水位超出TBD的净水生物盘管进水口标高的0.5
自2015年6月至2015年12月, 逐月对T1—T4的进、出水口进行水样采集与检测.水样的pH值使用HANNA HI 98129型pH计在现场测定, 水样的NH4+-N、NO3--N、NO2--N、TN浓度及COD
实验结束后对脱氮效果最好的TBD的填料生物膜进行样本采集, 取样位置在该TBD的净水生物盘管末端(距离出水口20 cm处).生物膜样品采集及预处理方法如下:将运行中的TBD填料取出, 放入自封袋并立即带回实验室于4 ℃冷藏; 快速用事先准备好的锥形瓶装好适量无菌水与样品, 振荡, 待基质表面附着物振荡脱落, 将悬浊液倒入离心管离心, 取离心管下部固体物, 并于
生工生物工程(上海)股份有限公司采用Power Soil DNA分离试剂盒提取样品中的DNA.采用1%的琼脂糖凝胶电泳检测提取的细菌总DNA.对16S rRNA基因的V3—V4高变区片段进行PCR扩增, 引物序列为515F(GTGCCAGCMGCCGCGGTAA)和909R(CCCCGYCAAT TCMTTTRAGT).随后在该公司的Illumina MiSeq平台上进行高通量测序分析, 得到原始图像数据文件经CASAVA碱基识别分析转化为原始测序序列, 结果以FASTQ文件格式储存.利用Mothur对原始序列进行校正, 去除序列中的嵌合体, 得到优化序列; 在97%的相似性水平上将序列划分可操作分类单元(operational taxonomic units, OTUs); 采用RDP Classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类分析, 继而计算样品文库覆盖率(Coverage)、Chao1指数及Shannon多样性指数, 并在属水平上统计每个样品的群落组成[22-23].
1.4 数据处理数据统计分析采用Excel 2016软件, 图表绘制采用Origin 9.1软件, 并用SPSS 20.0软件对不同基质类型的TBD硝化及反硝化性能进行ANOVA方差分析.
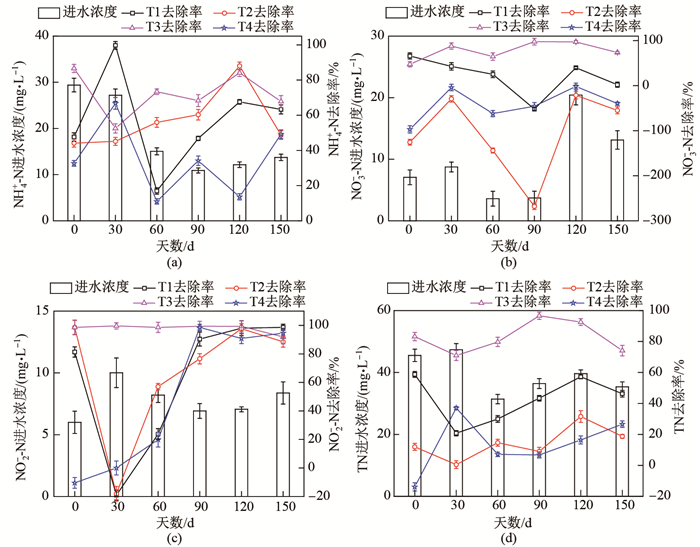
2 结果与分析 2.1 不同基质类型的强化脱氮性能对比图 2展示了4组不同填充基质的TBD在150 d的试验运行期中NH4+-N、NO3--N、NO2--N和TN的进水浓度及NH4+-N、NO3--N、NO2--N和TN的去除率趋势.
|
图 2 4组TBD对NH4+-N (a)、NO3--N (b)、NO2--N (c)、TN (d)的去除性能 Fig.2 The NH4+-N (a), NO3--N (b), NO2--N (c), TN (d) removal performance of the four TBDs |
由图 2(a)可知, 4组TBD中对NH4+-N去除率最高的是T3 (平均72%), 其次是T2 (平均57%), T1 (平均57%)和T4 (平均34%).结果表明, T3的出水NH4+-N浓度除试验运行的第30天外, 其余时段均可满足《城镇污水处理厂污染物排放标准》(GB 18918-2002)规定的一级A标准(NH4+-N
试验过程中, T3对NH4+-N的去除率与T1、T2和T4对NH4+-N的去除率具有显著差异(
由图 2(b)可知, T3对NO
监测结果表明, 试验进水的C/N为0.3
由图 2(c)可知, T3在试验全程中对NO2--N的去除率最佳(平均97%), 而T1 (平均62%)、T2 (平均66%)和T4 (平均48%)在试验初期均发生了亚硝酸盐积累的现象.
水体中亚硝酸盐的积累不但对生物和人体健康造成严重损害, 而且会对反硝化菌产生毒害作用, 使反硝化过程受到严重抑制[31].而亚硝酸盐产生积累意味着微生物对污水中氮素的硝化及反硝化作用不完全[32].由此可见, 相比其他试验组, T3中微生物的硝化及反硝化作用始终较为完全, 表明T3具有良好的强化脱氮性能.相关研究表明, 污水的C/N
试验进水的TN浓度变化及T1、T2、T3和T4对TN的去除率趋势如图 2(d)所示.结果表明, T3对TN的去除率最高(平均82%), 其次是T1 (平均42%)、T2 (平均14%)和T4 (平均13%). T3出水TN浓度均能达到《城镇污水处理厂污染物排放标准》(GB 18918—2002)规定的一级A标准(TN浓度限值为15 mg/L), T1出水TN浓度均可满足一级B标准(TN浓度限值为20 mg/L), 而T2和T4出水TN浓度几乎未达到一级B标准.王曼曼等将丝瓜络、甘蔗渣等固体材料用于为期50 d的水体脱氮批次实验[15], 结果表明丝瓜络和甘蔗渣均具备良好的脱氮性能, 其中丝瓜络对TN的去除率为71%, 甘蔗渣对TN的去除率更佳, 为94%, 这与本文中T3对TN的去除率最高的研究结果一致.反硝化是实现氮素从水体中脱除的关键步骤. 4组管式生物净水装置的TN去除率呈现T3
试验过程中, T3对TN去除率与T1、T2和T4对TN的去除率均具有显著差异(
为解析TBD对城镇生活污水厂强化脱氮的微生物作用机制, 本研究对脱氮性能最佳的T3中净水生物盘管末端填料的生物膜样本进行高通量测序, 共得到25 908条优质序列, 并以97%相似度划分, 共得到3 947个OTU分类单元.样品文库的覆盖率(Coverage)为90.90%, 说明样品中基因序列被检出的概率很高, 本次测序结果能够代表基质表面微生物群落的真实情况.
在微生物群里多样性分析中, 通常采用Chao1指数反映物种丰度, Chao1指数越高, 表示其物种越丰富; 采用Shannon指数反映物种的多样性, Shannon指数越高, 表示其物种多样性越高[39].通过计算得知, 该样品的Chao1指数为9 743.55, Shannon指数为6.37, 该结果高于仝欣楠等运用传统工艺进行水体强化脱氮研究中生物膜样品的物种丰度和多样性[40], 表明T3的净水生物盘管中微生物物种丰度和多样性较高, 其原因可能是净水生物盘管的相对密闭结构以及甘蔗渣的释碳作用有利于为微生物提供相对稳定且营养充足的生长环境, 从而提高微生物物种丰度及群落结构多样性[34, 41].
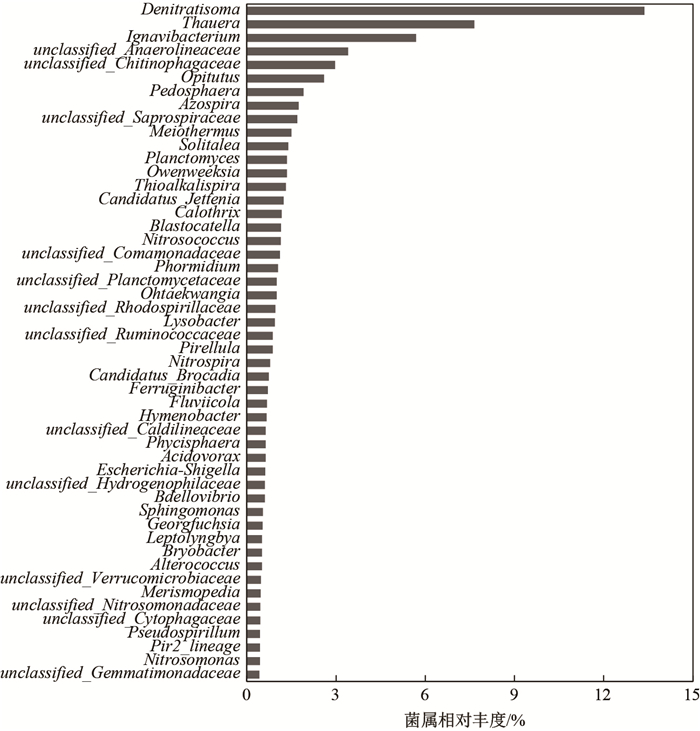
2.2.2 微生物群落结构为了揭示T3生物膜样品中的微生物菌群结构, 将97%相似水平的OTU代表序列在属水平上进行分类统计(见图 3).分析发现在该反应器系统中Denitratisoma菌属为主要优势菌属, 该菌属占菌群总体的13.4%;其次为Thauera菌属和Ignavibacterium菌属, 分别占菌群总体的7.7%和5.7%. Denitratisoma菌属和Thauera菌属均是典型的异养兼性厌氧反硝化菌, 其广泛分布于污水厂活性污泥及人工湿地基质中[39, 42].而Ignavibacterium菌属通常具备光合作用但不产氧, 常存在于光线良好的无氧环境[43]. Ignavibacterium菌属的富集从侧面反映出反应器内部形成了缺氧环境.
|
注:未展示比例小于0.5%的菌属 图 3 T3生物膜样本在属层面上的群落组成 Fig.3 Bacterial community composition at the genus level of the biofilm sample from T3 |
除上述3种优势菌属外, 生物膜样品中具备反硝化功能的菌属还有Azospira菌属、Bacillus菌属、Flavobacterium菌属、Rhodobacter菌属及Comamonas菌属[39, 42], 其所占比例分别为1.74%、0.27%、0.36%、0.15%和0.13%.加上优势菌属中的Denitratisoma菌属和Thauera菌属, 具有反硝化功能的菌属比例可达23.75%, 表明生物膜样品中含有较丰富的反硝化相关菌群.该生物膜样品中具有硝化功能的菌属主要包括Nitrobacter菌属、Nitrosospira菌属和Nitrosomonas菌属等[44], 其所占比例分别为0.96%、1.90%和1.43%, 表明硝化相关菌群的比例较少, 这可能是由于该生物膜样品的取样位置位于管式生物反应器的末端, 其管内水体的缺氧环境不利于硝化细菌的生长.另外, 生物膜样品中的Candidatus菌属为厌氧氨氧化相关菌属[45-46], 其占比合计2.0%.相关研究表明, 厌氧氨氧化菌和反硝化菌可以共生并通过协同作用强化对污水中氮素的去除[47].
综上, 填充甘蔗渣的TBD内部微生物群落结构中反硝化相关菌属占绝对优势(23.75%), 并含有一定比例的硝化(7.73%)及厌氧氨氧化(2.0%)相关菌属, 表明填充甘蔗渣的TBD内部环境有利于脱氮功能菌群的富集和生长.
3 结论(1) 以甘蔗渣为填充基质的TBD对污水的脱氮性能明显优于其他基质, 对NH4+-N、NO3--N、NO2--N及TN的平均去除率分别可达72%、64%、97%和82%, 经净化的水体NH4+-N及TN浓度均可满足《城镇污水处理厂污染物排放标准》(GB 18918—2002)规定的一级A标准, 因此甘蔗渣是TBD的最佳填充基质.
(2) 填充甘蔗渣的TBD的微生物物种丰度和多样性较高(Chao1指标为9 743.55, Shannon指标为6.37), 原因可能是净水生物盘管的相对密闭结构以及甘蔗渣的释碳作用为微生物提供了相对稳定且营养充足的生长环境.
(3) 填充甘蔗渣的TBD内部微生物群落结构中反硝化相关菌群占绝对优势(23.75%), 并含有一定比例的硝化(7.73%)及厌氧氨氧化(2.0%)相关菌属, 表明填充甘蔗渣的TBD内部环境有利于脱氮功能菌群的富集和生长.
| [1] |
QIN B, GAO G, ZHU G, et al. Lake eutrophication and its ecosystem response[J]. Chinese Science Bulletin, 2013, 58(9): 961-970. DOI:10.1007/s11434-012-5560-x |
| [2] |
刘海琴, 邱园园, 闻学政, 等. 4种水生植物深度净化村镇生活污水厂尾水效果研究[J]. 中国生态农业学报, 2018(4): 616-626. |
| [3] |
姚敬博, 邵亮. 某城市污水处理厂提标改造工艺探讨[J]. 辽宁化工, 2017(5): 498-501. |
| [4] |
赵银慧, 李莉娜, 景立新, 等. 污水处理厂氮排放特征[J]. 中国环境监测, 2015(4): 58-61. DOI:10.3969/j.issn.1002-6002.2015.04.010 |
| [5] |
陈立, 李成江, 郭兴芳, 等. 城镇污水处理厂提标改造的几点思考[J]. 水处理技术, 2011(9): 120-122. |
| [6] |
王建华, 陈永志, 彭永臻. 低碳氮比实际生活污水A~2O-BAF工艺低温脱氮除磷[J]. 中国环境科学, 2010(9): 1195-1200. |
| [7] |
陈翰, 马放, 李昂, 等. 低温条件下污水生物脱氮处理研究进展[J]. 中国给水排水, 2016(8): 37-43. |
| [8] |
黄民生, 崔贺, 常越亚, 等.一种管式生物净水装置及其净水方法: 201510377317.1[P]. 2015-10-14.
|
| [9] |
李斌, 郝瑞霞, 赵文莉. 玉米芯与海绵铁复合填料的反硝化脱氮特性[J]. 中国给水排水, 2014(7): 31-34. |
| [10] |
张翔凌, 阮聪颖, 黄华玲, 等. 不同类型LDHs覆膜改性人工湿地生物陶粒基质脱氮效果研究[J]. 环境科学学报, 2015(10): 3178-3184. |
| [11] |
张雁秋, 曹文平, 刘莉, 等. 基质对生态浮床净化效果和大型水生植物生长的影响[J]. 徐州工程学院学报(自然科学版), 2013(4): 18-23. |
| [12] |
栾晓男, 田云飞, 郑力, 等. 丝瓜络填料反硝化滤池对生活污水的净化[J]. 环境工程学报, 2016(7): 3471-3476. |
| [13] |
王营章, 张尚华, 刘志强, 等. 丝瓜络填料SBBR对生活污水脱氮除磷的试验研究[J]. 工业水处理, 2012(11): 55-58. |
| [14] |
马占青, 温淑瑶. 棕毛纤维介质对富营养化水体净化效果的研究[J]. 农业工程学报, 2008(9): 229-233. DOI:10.3321/j.issn:1002-6819.2008.09.047 |
| [15] |
王曼曼, 汪家权, 褚华男. 固态碳源去除地下水硝酸盐的模拟实验[J]. 环境工程学报, 2013(2): 501-506. |
| [16] |
邵留, 徐祖信, 金伟, 等. 农业废物反硝化固体碳源的优选[J]. 中国环境科学, 2011(5): 748-754. |
| [17] |
陈耀章. 接触氧化填料问题的探讨[J]. 石油化工环境保护, 1992(3): 5-9. |
| [18] |
杨旻, 吴小刚, 张维昊, 等. 富营养化水体生态修复中水生植物的应用研究[J]. 环境科学与技术, 2007(7): 98-102. DOI:10.3969/j.issn.1003-6504.2007.07.036 |
| [19] |
李哲, 王喜山, 赵国臣, 等. 生菜的营养价值及高产栽培技术[J]. 吉林蔬菜, 2014(9): 14-15. DOI:10.3969/j.issn.1672-0180.2014.09.012 |
| [20] |
杨乐.污水厂节地方法初探与强化脱氮实验研究[D].上海: 华东师范大学, 2016.
|
| [21] |
韩剑宏, 刘燕, 朱浩君, 等. 反硝化生物滤池的自然挂膜启动研究[J]. 中国给水排水, 2015(3): 1-4. |
| [22] |
QUAST C, PRUESSE E, YILMAZ P, et al. The SILVA ribosomal RNA gene database project: Improved data processing and web-based tools[J]. Nucleic Acids Research, 2013, 41(D1): D590-D596. |
| [23] |
李治玲.生物炭对紫色土和黄壤养分、微生物及酶活性的影响[D].重庆: 西南大学, 2016. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D01029689
|
| [24] |
马勇, 彭永臻, 于德爽. A/O生物脱氮工艺处理生活污水中试(二)系统性能和SND现象的研究[J]. 环境科学学报, 2006(5): 710-715. DOI:10.3321/j.issn:0253-2468.2006.05.002 |
| [25] |
ZHAO W H, ZHANG Y, LYU D M, et al. Advanced nitrogen and phosphorus removal in the pre-denitrification anaerobic/anoxic/aerobic nitrification sequence batch reactor (pre-A2NSBR) treating low carbon/nitrogen (C/N) wastewater[J]. Chemical Engineering Journal, 2016, 302: 296-304. DOI:10.1016/j.cej.2016.05.012 |
| [26] |
刘欢, 王源, 骆灵喜, 等. 城市污水处理厂高溶解氧尾水脱氮研究[J]. 广东化工, 2016(14): 26-28. DOI:10.3969/j.issn.1007-1865.2016.14.012 |
| [27] |
KUBA T, VANLOOSDRECHT M, HEIJNEN J J. Phosphorus and nitrogen removal with minimal cod requirement by integration of denitrifying dephosphatation and nitrification in a two-sludge system[J]. Water Research, 1996, 30(7): 1702-1710. DOI:10.1016/0043-1354(96)00050-4 |
| [28] |
CHOI C, LEE J, LEE K, et al. The effects on operation conditions of sludge retention time and carbon/nitrogen ratio in an intermittently aerated membrane bioreactor (IAMBR)[J]. Bioresource Technology, 2008, 99(13): 5397-5401. DOI:10.1016/j.biortech.2007.11.016 |
| [29] |
韦钦胜, 王保栋, 陈建芳, 等. 长江口外缺氧区生消过程和机制的再认知[J]. 中国科学:地球科学, 2015(2): 187-206. |
| [30] |
徐亚同. 废水反硝化除氮[J]. 上海环境科学, 1994(10): 8-12. |
| [31] |
乔启成, 杨燕舞, 王立章. 亚硝化控制技术的研究现状与动向[J]. 环境技术, 2005(5): 47-49. |
| [32] |
SVEHLA P, JENICEK P, HABART J, et al. Use of the accumulation of nitrite in biological treatment of waste water[J]. Chemicke Listy, 2009, 103(3): 255. |
| [33] |
袁怡, 黄勇, 邓慧萍, 等. C/N比对反硝化过程中亚硝酸盐积累的影响分析[J]. 环境科学, 2013(4): 1416-1420. |
| [34] |
BORGES M T, MORAIS A, CASTRO P. Performance of outdoor seawater treatment systems for recirculation in an intensive turbot (Scophthalmus maximus) farm[J]. Aquaculture International, 2003, 11(6): 557-570. DOI:10.1023/B:AQUI.0000013308.33265.62 |
| [35] |
WU Q, HU Y, LI S, et al. Microbial mechanisms of using enhanced ecological floating beds for eutrophic water improvement[J]. Bioresource Technology, 2016, 211: 451-456. DOI:10.1016/j.biortech.2016.03.113 |
| [36] |
CAO W, ZHANG Y. Removal of nitrogen (N) from hypereutrophic waters by ecological floating beds (EFBs) with various substrates[J]. Ecological Engineering, 2014, 62: 148-152. DOI:10.1016/j.ecoleng.2013.10.018 |
| [37] |
LI L, HE C, JI G, et al. Nitrogen removal pathways in a tidal flow constructed wetland under flooded time constraints[J]. Ecological Engineering, 2015, 81: 266-271. DOI:10.1016/j.ecoleng.2015.04.073 |
| [38] |
LI H D, ZHANG L, LIU J L, et al. Anti-shock Loading Performance of OAA/SBR Process in Biological Nitrogen Removal[J]. China Water & Wastewater, 2016, 32: 80-83. |
| [39] |
CHEN Y, ZHAO Z, PENG Y, et al. Performance of a full-scale modified anaerobic/anoxic/oxic process: High-throughput sequence analysis of its microbial structures and their community functions[J]. Bioresource Technology, 2016, 220: 225-232. DOI:10.1016/j.biortech.2016.07.095 |
| [40] |
仝欣楠, 王欣泽, 何小娟, 等. 人工芦苇湿地氨氮污染物去除及氨氧化菌群落多样性分析[J]. 环境科学研究, 2014(2): 218-224. |
| [41] |
GAO L, ZHOU W, HUANG J, et al. Nitrogen removal by the enhanced floating treatment wetlands from the secondary effluent[J]. Bioresource Technology, 2017, 234: 243-252. DOI:10.1016/j.biortech.2017.03.036 |
| [42] |
ZHONG F, WU J, DAI Y, et al. Bacterial community analysis by PCR-DGGE and 454-pyrosequencing of horizontal subsurface flow constructed wetlands with front aeration[J]. Applied Microbiology & Biotechnology, 2015, 99(3): 1499-1512. |
| [43] |
LIU Z, FRIGAARD N, VOGL K, et al. Complete genome of Ignavibacterium album, a metabolically versatile, flagellated, facultative anaerobe from the phylum Chlorobi[J]. Frontiers in Microbiology, 2012(3): 185. |
| [44] |
HE Y, ZHOU G M, ZHAO Y C. Nitrification with high nitrite accumulation for the treatment of "Old" landfill leachates[J]. Environmental Engineering Science, 2007, 24(8): 1084-1094. DOI:10.1089/ees.2006.0250 |
| [45] |
NIKOLAEV A, KOZLOV M N, KEVBRINA M V, et al. Candidatus "Jettenia moscovienalis" sp. nov., a new species of bacteria carrying out anaerobic ammonium oxidation[J]. Mikrobiologiia, 2015, 84(2): 236-243. |
| [46] |
ALI M, HAROON M F, NARITA Y, et al. Draft genome sequence of the anaerobic ammonium-oxidizing bacterium "Candidatus Brocadia sp. 40"[J]. Genome Announcements, 2016, 4(6): e01377-16. |
| [47] |
张诗颖, 吴鹏, 宋吟玲, 等. 厌氧氨氧化与反硝化协同脱氮处理城市污水[J]. 环境科学, 2015(11): 4174-4179. |




