2. 华东师范大学 上海市城市化生态过程与生态恢复重点实验室, 上海 200241
2. Shanghai Key Lab for Urban Ecological Processes and Eco-Restoration, East China Normal University, Shanghai 200241, China
城镇污水处理厂硝化效率的提升是目前研究的热点问题[1].参与硝化作用的微生物类群(硝化细菌)是一类化能自养型细菌, 因其具有能量利用率低、增殖缓慢、生长易受环境影响等特点导致硝化效率提升难度大[2-3].据报道, 通过对2013年全国11座城市122家污水处理厂尾水监测发现, 约1/6的污水厂尾水氨氮(NH
目前, 污水厂强化硝化的主要方式有优化反应器运行参数(溶解氧、污泥龄等)、接种更高效的硝化细菌和提高微生物浓度等[5].但相关研究表明, 当反应器中溶解氧达到一定浓度后, 其提升效果并不明显[6]; 增加污泥龄需要增大相应构筑物的容积, 不利于已有污水厂的升级改造[7]; 而在反应器外部单独培养的硝化细菌并不一定能很快适应污水处理系统环境, 所以接种更高效的硝化细菌也不易达到强化硝化的目的[8].相比上述几种强化硝化方式, 在反应器中添加填料或其他固定化方式, 可以增加硝化细菌的浓度, 从而提升污水处理的硝化效率[9].已有研究表明, 沸石粉在生物脱氮处理工艺中既可作为生物膜载体, 又对水体中的氨氮(NH
鉴于此, 本研究提出了一种包裹沸石粉与硝化细菌的新型悬浮填料, 用于城镇污水厂的强化硝化模拟试验研究, 并根据填料有无沸石粉和硝化细菌的组合设计出3组试验装置.通过监测3组试验装置进出水氨氮(NH
本试验于2015年7月8日-8月25日在实验室进行.试验装置(见图 1)均由PVC板焊接而成, 尺寸均为80 cm
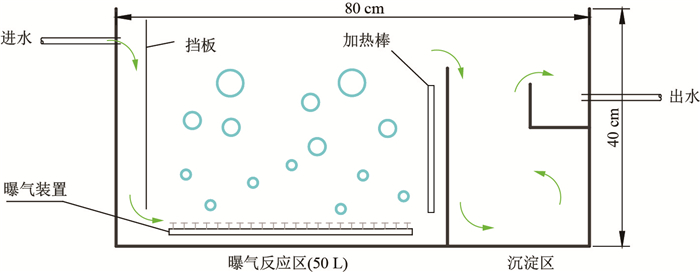
|
图 1 悬浮填料强化硝化实验装置 Fig.1 Experimental device for enhanced nitrification of suspended fillers |
| 表 1 悬浮填料强化硝化实验各装置运行参数 Tab. 1 Operating parameters of various devices for enhanced nitrification |
本次试验所用硝化污泥取自上海市天山污水厂二沉池, 硝化细菌经富集培养(配方见表 2)后转移至有效容积为120 L的大型培养装置内扩培[11].本试验中新型悬浮填料的制作方法为:将大块无纺布裁剪成6 cm
| 表 2 硝化细菌富集培养基基本配方 Tab. 2 Basic composition for nitrifying bacteria enrichment medium |
实验开始阶段, 分别在各装置内加入2 L硝化细菌混合液, 加速装置内填料的挂膜.其中硝化细菌混合液MLSS为62.8 mg/L.试验进水为人工配水, NH
试验运行期间, 对3个装置的出水进行采样(采样周期为24 h), 采集水样(约1 L)后, 装入黑色采样瓶并立即检测, 如需隔夜放置, 则应放置于4 ℃冷藏箱.水样的NH
在试验系统运行结束后, 对装置1、装置2和装置3中的悬浮填料生物膜样品进行采集和微生物高通量测序.
本研究涉及到的数据采用Microsoft Excel 2007、SPSS 22和Origin 2016等软件处理.
2 结果与讨论 2.1 NH本研究的3组试验装置从2015年7月8日运行至8月25日, 共计49 d.由图 2可知, 各装置对NH
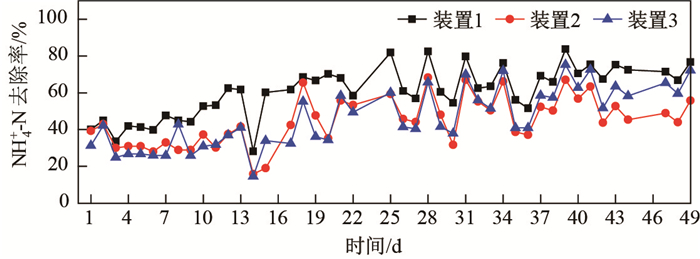
|
图 2 装置1-3 NH |
由图 3可以看出, 系统运行前期, NO
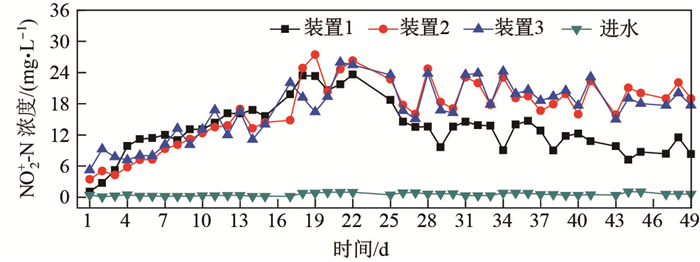
|
图 3 装置1-3 NO |
从图 4可以看出, 装置1-3的平均NO
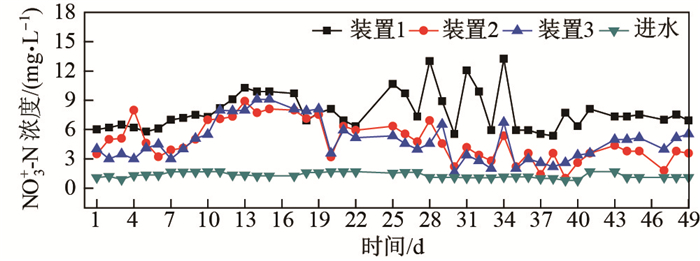
|
图 4 装置1-3以及进水NO |
综上所述, 装置1硝化效果最好, 其原因可能是采用"沸石粉-硝化细菌"新型悬浮填料对污水进行强化硝化过程中, 沸石粉自身吸附NH
在实验系统运行结束后, 对3个装置中悬浮填料的生物膜样品进行采集和高通量测序, 得出试验运行后期装置填料中微生物的群落结构及其多样性, 从而解析填料对污水强化硝化的微生物作用机制.
2.4.1 微生物群落多样性对装置1、装置2及装置3中的填料生物膜样本进行高通量测序, 共得到111 120条优质序列, 并以97%相似度划分, 共得到11 990个OTU分类单元.样品文库的覆盖率(Coverage)大于90%, 说明测序结果能够较准确地反映样品生物特性.
Shannon和Simpson指数用来反应物种的多样性, Shannon指数越高, Simpson指数越小表示其物种越丰富, ACE和Chao1指数用来反应物种丰度, 也是用来估计OTUs数目的指数[16].结果表明, 3个生物膜样品中的Shannon指数大小排序为样品2
为了揭示试验装置生物膜样品中的微生物菌群结构, 将97%相似水平的OTU代表序列在属水平上进行分类统计(见图 5).分析发现在该反应器系统中Nitrosomonas菌属(亚硝化单胞菌属)、Candidatus_Brocadia菌属以及Nitrospira菌属(硝化螺旋菌属)为主要优势菌属. Nitrosomonas菌属(亚硝化单胞菌属)在装置1-3中所占的比例分别为13.2%、4.1%和21.9%, 该菌属可在好氧条件下将水体中的NH
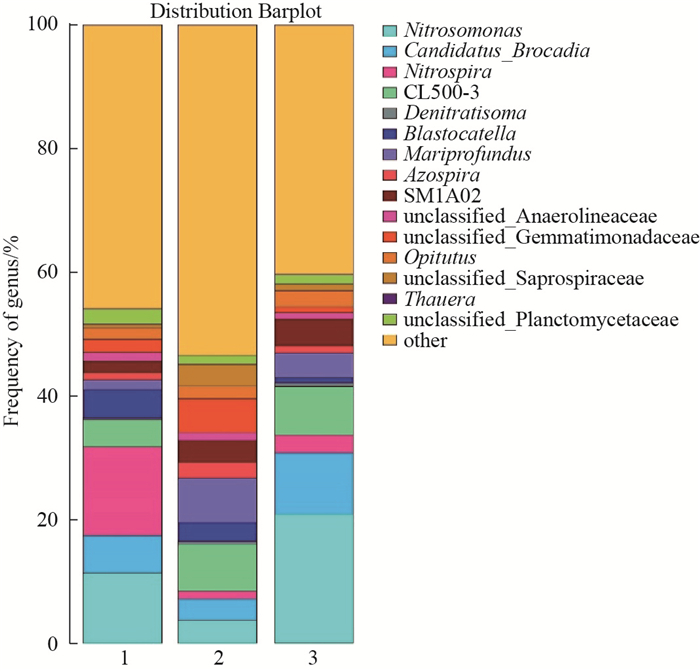
|
图 5 试验装置填料生物膜样本在属水平层面上的群落组成 Fig.5 Bacterial community composition at the genus level of the filler biofilm sample used in the experiment |
以上结果表明, 装置1的填料中沸石粉的引入促进了生物膜中Nitrospira菌属的比例, Nitrospira菌属能够将水体中Nitrosomonas菌属代谢生成的NO
综上, 用于强化脱氮的新型悬浮填料在接种硝化细菌菌液后, 填料生物膜中的Nitrosomonas菌属占优势, 从而为体系中NH
(1) 通过监测3组试验装置进出水NH
(2) 通过对填料生物膜样品的微生物群落多样性分析可知, 新型悬浮填料中沸石粉的加入更有利于硝化相关菌属的富集和生长, 从而造成微生物物种多样性的降低, 至于其形成机理还有待于进一步研究.
(3) 用于强化硝化的新型悬浮填料的生物膜中的Nitrosomonas菌属占绝对优势, 从而为体系中NH
| [1] |
周振, 唐建国, 张爱平, 等. 城镇污水处理厂强化硝化技术现状分析[J]. 中国给水排水, 2013, 20: 5-8. |
| [2] |
刘秀红, 彭永臻, 马涛, 等. 硝化类型对污水脱氮过程中N_2O产生量的影响[J]. 中国环境科学, 2007(5): 633-637. |
| [3] |
王小菊, 何春平, 王震, 等. 高效硝化细菌的筛选及特性研究[J]. 中国环境科学, 2013(2): 286-292. |
| [4] |
赵银慧, 李莉娜, 景立新, 等. 污水处理厂氮排放特征[J]. 中国环境监测, 2015(4): 58-61. |
| [5] |
魏继林, 彭党聪, 聂玲, 等. 硝化菌添加强化硝化实验研究[J]. 水处理技术, 2014(7): 111-115. |
| [6] |
GEMAEY K V, JJORGENSEN S B. Benchmarking combined biological phosphorus and nitrogen removal wastewater treatment processes[J]. Control Engineering Practice, 2004, 12(3): 357-373. DOI:10.1016/S0967-0661(03)00080-7 |
| [7] |
周海东, 刘勤亚, 张业健. 泥龄应用中有关问题的探讨[J]. 污染防治技术, 2003(2): 13-16. |
| [8] |
BOUCHEZ T, PATUREAU D, DABERT P, et al. Ecological study of a bio augmentation failure[J]. Environ Microbiol, 2000(2): 179-190. |
| [9] |
刘少敏, 储磊, 朱敬林. 固定化硝化细菌去除生活污水中的氨氮[J]. 环境工程学报, 2014(10): 4261-4266. |
| [10] |
陈彬.沸石强化生物脱氮工艺试验研究[D].上海: 同济大学, 2006. http://d.wanfangdata.com.cn/Thesis_Y851410.aspx
|
| [11] |
沈萍, 陈向东. 微生物学[M]. 北京: 高等教育出版社, 2006.
|
| [12] |
国家环境保护总局水和废水监测分析方法编委会. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002.
|
| [13] |
李运林.生物沸石填料去除城市污水厂二级出水中氨氮的试验研究[D].郑州: 郑州大学, 2009. http://cdmd.cnki.com.cn/article/cdmd-10459-2010054031.htm
|
| [14] |
刘富龙.氨氮浓度对硝化反应影响的研究[D].太原: 太原理工大学, 2009. http://d.wanfangdata.com.cn/Thesis/D081477
|
| [15] |
SVEHLA P, JENICEK P, HABART J, et al. Use of the accumulation of nitrite in biological treatment of waste water[J]. Chemicke Listy, 2009, 103(3): 255. |
| [16] |
CHEN Y, ZHAO Z, PENG Y, et al. Performance of a full-scale modified anaerobic/anoxic/oxic process:Highthroughput sequence analysis of its microbial structures and their community functions[J]. Bioresource Technology, 2016, 220: 225-232. DOI:10.1016/j.biortech.2016.07.095 |
| [17] |
魏佳明, 崔丽娟, 李伟, 等. 表流湿地细菌群落结构特征[J]. 环境科学, 2016(11): 4357-4365. |
| [18] |
GUNDERSEN K. Preservation of nitrosomonas[J]. Nature, 1957, 179(4563): 789. DOI:10.1038/179789a0 |
| [19] |
MANORU OSHIKI, KAORI SHINYAKO-HATA, HISASHI SATOH, et al. Draft genome sequence of an anaerobic ammonium-oxidizing bacterium, "Candidatus Brocadia sinica"[J]. Genome Announcements, 2015, 3(2): 1-2. |
| [20] |
DAIMS H, WAGNER M. Nitrospira[J]. Trends in Microbiology, 2018, 26(5): 462-463. DOI:10.1016/j.tim.2018.02.001 |



