磺胺类抗生素(sulfonamide antibiotics, SAs)是一类重要的抗生素类药物, 因其抗菌范围广、价格低廉、效果好等优点而广泛用于人类和动物相关疾病的防治中, 而且较其他种类的抗生素使用量更大[1-2].然而磺胺类药物在动物性食品中容易残留, 对人体健康产生一定危害[3].包括美国和欧盟在内的大多数国家规定了动物源性食品中磺胺类药物的最大残留量为100 μ g/kg[4], 我国规定了动物源性食品中磺胺类药物的最大残留量为50~ 100 μg/kg[5].因此研究灵敏度高的食品中磺胺类药物检测方法具有重要意义.
目前, 对食品中磺胺类药物残留的检测方法较多, 其中高效液相色谱是最常用的分析方法[6].基于食品中基质的复杂性和药物残留含量低的特点, 样品前处理是检测过程中不可缺少的重要环节.现今常用的前处理方法有液-液萃取[7]、超声波辅助萃取[8]、固相萃取[9]、液相微萃取[10]和固相微萃取[11]等.其中, 中空纤维膜液相微萃取具有样品纯化能力好、富集倍数高、有机试剂用量少等优点, 近年来得到越来越多的重视[12-13].而且利用中空纤维膜液相微萃取进行前处理时, 中空纤维膜是一次性使用, 避免了交叉感染, 从而增加了样品测试结果的准确度[14-15].
本实验用中空纤维膜液相微萃取-超高压液相色谱联用技术, 建立了测定鸡肉中6种磺胺类药物残留的超高压液相色谱检测分析方法.经中空纤维膜液相微萃取, 富集倍数可以达到188~ 950倍, 检出限为0.03~ 0.1 ng/mL.在加标浓度为50 μ g/kg的鸡肉组织样品的加标回收率为85.2%~ 95.6%, 相对标准偏差为3.13%~ 4.33%(n=5).表明本方法准确可靠, 为检测禽类中磺胺类抗生素残留的分析提供新的方法.
1 实验部分 1.1 仪器与试剂岛津超高压液相色谱仪UHPLC-30A (配二元泵、在线脱气和二极管阵列检测器); Q3/2 Accurel PP聚丙烯微孔中空纤维膜(壁厚200 μ m, 内直径600 μ m, 孔尺0.2 μ m, 多孔性75%)购自Membrana公司(Wuppertal, 德国); 微量注射器(10 μL, 针头外径0.3 mm, 长5.5 cm)购自上海光正医疗仪器有限公司(中国); KQ-2200DE超声清洗仪(昆山舒美超声仪器有限公司); ME104E电子天平(梅特勒-托利多国际贸易有限公司); 赛多利斯pH计(PB-10型); 旋涡混合器(其林贝尔VORTEX-5); 0.22 μ m一次性微孔滤膜.
磺胺甲噁唑(SMX)、磺胺二甲氧基嘧啶(SDM)购于sigma-aldrich, 磺胺甲基嘧啶(SM1)、磺胺二甲基嘧啶(SMZ)购于Alfa Aesar, 磺胺(SAs)、磺胺嘧啶(SD), 甲醇和乙腈都是色谱纯, 其余试剂均为分析纯, 均购于国药集团化学试剂有限公司, 实验所有用水均为超纯水.
准确称取标准品SMX、SDM、SM1、SMZ、SAs和SD各2 mg, 分别用超纯水定容至100 mL, 即得到6种磺胺的标准储备液, 4℃冰箱保存.
1.2 实验方法 1.2.1 样品前处理实验所用的鸡肉样品购于当地农贸市场的新鲜食品.
准确称取5 g鸡肉样品(精确至0.001 g), 置于50 mL离心管中, 加入20 mL乙酸乙酯, 涡动2 min, 以4 000 r/min离心5 min.上清液倒入50 mL鸡心瓶中, 残渣再加入乙酸乙酯20 mL, 重复提取一次.合并两次提取液, 加入0.1 mol/L盐酸溶液4 mL, 于40 ℃旋转蒸发仪浓缩至少于3 mL, 转至10 mL离心管中, 依次用0.1 mol/L盐酸溶液2 mL、正己烷3 mL洗鸡心瓶.然后转至离心管, 涡旋30 s, 3 000 r/min离心5 min, 弃正己烷.再次用正己烷3 mL洗鸡心瓶, 重复洗一次, 弃正己烷, 取下层液备用.
MCX柱依次用2 mL的甲醇和2 mL的0.1 mol/L盐酸溶液活化, 取提取的备用液过柱, 控制流速为1 mL/min, 依次用1 mL的0.1 mol/L盐酸溶液和2 mL的50%甲醇乙腈溶液淋洗, 再用洗脱液4 mL洗脱.最后收集洗脱液, 用40 ℃氮气吹干, 然后加超纯水10 mL溶解残余物, 用0.22 μ m的滤膜过滤, 供萃取使用.
1.2.2 色谱条件色谱柱为Shim-pack GISS C18 (2.1 mm× 100 mm, 1.9 μ m), 流速为0.2 mL/min, 柱温为40°, 流动相采用体积比乙腈:水=55: 45, 最佳吸收波长为269 nm, 进样量为10 μL.
1.2.3 富集条件萃取参数的优化采用统一的标准混合溶液.萃取方法是将中空纤维膜剪成约5 cm, 放入丙酮中超声清洗10 min后放在通风橱中自然风干, 然后热封一端后, 将接收液小心注入中空纤维膜中, 热封另一端, 使中空纤维膜处于"封闭"的环境.动态三相HF-LPME的装置简图如图 1所示.最佳萃取条件为:给出相体积8 mL, 其中盐酸浓度为1.0 mmol/L, Na2SO4的浓度为375 g/L; 接收相体积为8 μL, NaOH浓度为0.2 mol/L; 液膜(SLM)为正辛醇; 萃取温度为30 ℃; 搅拌速度为300 r/min; 萃取时间为4 h.
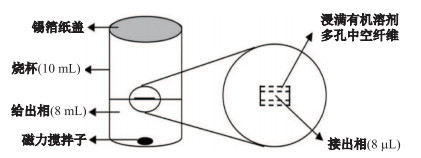
|
图 1 HF-LPME微萃取装置简图 Fig.1 Illustration of the microextraction apparatus for HF-LPME |
实验对影响分离的各种参数进行了优化, 包括了对流动相的种类和含量.对于UHPLC的检测, 通常使用在水中加入溶剂强度较大的溶剂, 如甲醇和乙腈等.分别采用体积含量为15%、25%、35%和45%的甲醇和乙腈作为流动相, 考察其对磺胺类抗生素分离的影响.实验结果表明, 由于乙腈的洗脱能力更好, 其为流动相时峰形更好.而且当乙腈含量为45%时, 6种磺胺能快速更好地分离出来, 保留时间在2~ 6 min, 标准谱图如图 2.所以最终选用的流动相是乙腈, 含量为45%.该流动相条件避免了缓冲盐溶液对色谱柱的损伤而且有效缩短了分析时间.
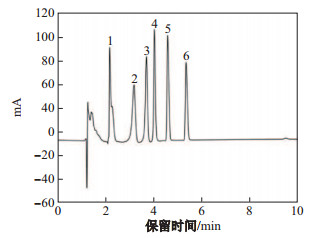
|
图 2 6种磺胺的高效液相色谱图 Fig.2 Chromatogram of standard solution of six sulfonamides by UHPLC |
磺胺类抗生素是一种常见的两性电解质, 其离子化过程可以分为两步来进行.因为磺胺类物质的亲水-疏水性质能通过pH来调节, 所以可以通过HF-LPME方法对磺胺类抗生素进行萃取和富集.通过调节给出相的pH使磺胺类抗生素呈分子状态, 同时调节接收相的pH使其呈离子状态.这样存在的pH差异为磺胺类抗生素从给出相进入到接收相溶液提供了主要的动力.该文考察了接收相NaOH溶液浓度(0.10, 0.15, 0.20, 0.25和0.30 mol/L)对磺胺类抗生素的影响.结果如图 3表明, 6种抗生素的富集倍数(EFs)在0.20 mol/L时达到最大, 因此选择NaOH溶液浓度为0.20 mol/L作为最佳萃取浓度.同时考察了给出相盐酸浓度(0.1, 0.5, 1.0, 5.0和10.0 mmol/L)对磺胺类抗生素的影响.结果如图 4所示, 随着给出相中盐酸浓度的增加, 6种磺胺类抗生素的EFs明显提高, 当盐酸浓度为1.0 mmol/L时, 各磺胺类抗生素开始下降.所以用盐酸浓度为1.0 mmol/L作为给出相.
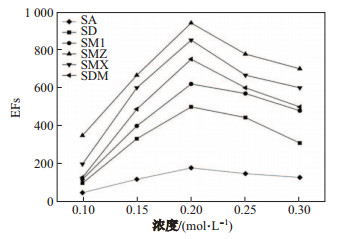
|
图 3 NaOH浓度对富集倍数的影响 Fig.3 Effect of the concentration of NaOH on EFs of six sulfonamide compounds |
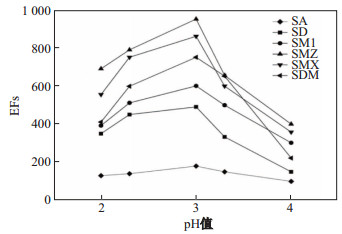
|
图 4 盐酸浓度对富集倍数的影响 Fig.4 Effect of the concentration of hydrochloric acid on EFs of six sulfonamide compounds |
由于盐析效应会降低待测物质在样品中的溶解度, 从而提高它们在萃取相中的分配, 进而提高萃取效率, 所以向样品溶液中加入一些无机盐, 例如Na2SO4等, 可以增强溶液的离子强度.在200~ 400 g/L范围内考察了Na2SO4浓度对萃取的影响.如图 5所示, 6种磺胺类抗生素的EFs随着给出相中的Na2SO4浓度的增加而增大.当Na2SO4浓度大于375 g/L时, 除了SMZ其他5种抗生素的EFs呈下降趋势.可能的原因是盐浓度过高导致抗生素分子通过膜进入有机相的速率降低, 从而不利于萃取.因此, 最后选择在样品溶液中加入浓度为375 g/L的Na2SO4来提高萃取效率.
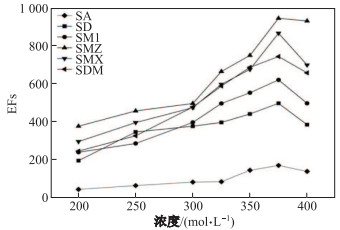
|
图 5 浓度对富集倍数的影响 Fig.5 Effect of the concentration of Na2SO4 on EFs of six sulfonamide compounds |
在萃取过程中, 萃取效率随着萃取温度的升高而得到提高, 是因为当温度升高时, 待萃取物质的质量传递系数增大, 扩散速度变快.但如果萃取温度过高, 可能会影响给出相和支撑液膜的稳定性, 或者会导致给出相中的水分挥发过快, 这些因素都可能会导致目标分析物的富集效果不稳定.所以, 为了分析萃取温度对萃取效率的影响, 将给出相的温度分别设为25、30、35、40和50 ℃.结果如图 6所示, 6种抗生素的EFs在30 ℃时达到最大, 因此选择30 ℃作为最佳萃取温度.
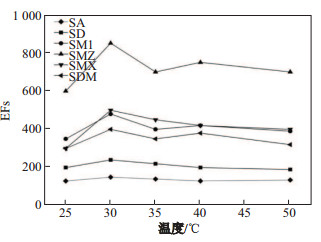
|
图 6 温度对富集倍数的影响 Fig.6 Effect of the extraction temperature on EFs of six sulfonamide compounds |
在动态的三相HF-LPME中, 待萃取物进入接收相溶液中的量随着萃取时间的延长而增加, 直至在某一平衡点达到最大值.本实验考察了萃取时间分别为2, 3, 4和5 h时, 6种磺胺类抗生素萃取效率的变化.根据实验结果图 7, 可以看出, 所有物质的EFs都随着萃取时间的延长而增大, 然而, 当时间超过4 h时, 回收的接收相溶液体积明显减少, 而且EFs明显减少.综合考虑到在平衡后继续延长萃取的时间会导致SLM的不稳定性从而导致萃取效率的降低以及萃取溶液的减少, 选择4 h作为最佳萃取时间.
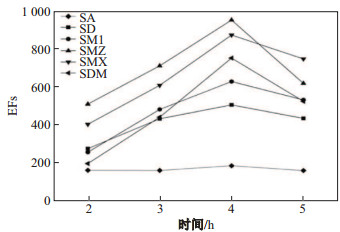
|
图 7 萃取时间对富集倍数的影响 Fig.7 Effect of the extraction time EFs of six sulfonamide compounds |
采用磁力搅拌能够加快给出相中的待萃取物质通过有机相扩散到接收相溶液中的速度, 这样可以缩短萃取时间, 进而提高EFs.但是过快的搅拌也会加速萃取溶剂分散到提取液中, 从而降低了萃取效率.因此, 在100~ 400 r/min范围内考察了给出相的搅拌速度对萃取效率的影响.如图 8结果表明, 在搅拌速度为300 r/min时, 6种抗生素的EFs达到最大值.所以, 在后续萃取过程中, 选择300 r/min作为最佳搅拌速度.
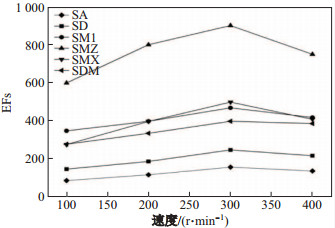
|
图 8 搅拌速度对富集倍数的影响 Fig.8 Effect of the stirring rate on EFs of six sulfonamide compounds |
综合上述, 对不同的给出相和接收相溶液的pH值、Na2SO4浓度、温度、时间和搅拌速度下, 6种磺胺类标准溶液的液相微萃取情况的分析, 根据萃取后接收相中分析物的浓度和萃取前样品中分析物的初始浓度之比得到富集倍数.可以得出在给出相中盐酸浓度为1.0 mmol/L, Na2SO4浓度为375 g/L; 接收相中NaOH浓度为0.2 mol/L, 温度为30 ℃, 搅拌速度为300 r/min, 时间为4 h的情况下, 中空纤维膜微萃取对于这6种磺胺类的富集倍数可以达到188~950倍, 明显提高了该方法的灵敏度.
2.3 线性范围和检出限准确移取不同量的标准磺胺类抗生素混合溶液, 在选定的最佳萃取条件和色谱分离条件下进行分离测定, 得到它们在(0.11~ 5.05)× 104 ng/mL的浓度范围内线性关系显著.其峰面积与其质量浓度的线性方程、相关系数见表 1, 其中相关系数R2均大于0.998~9.
| 表 1 6种磺胺类抗生素的线性关系、相关系数和检出限 Tab.1 Linear equations, correlation coefficients, and detection limits of six sulfonamide antibiotics |
在选取的色谱分离条件下, 将标准溶液进行稀释、分析, 根据3倍噪音的峰面积的响应值, 可以计算出最低检出限.测定结果表明, 6种磺胺类抗生素检出限为0.03~ 0.1 ng/mL(S/N=3), 此数值明显小于国内外对磺胺类残留的最高限度100 ng/g, 满足对鸡肉中磺胺类抗生素残留的分析检测.
2.4 实际样品检测对购于上海市农贸市场的鸡肉样品10个, 按照上述方法优化的条件下提取和富集后, 分别进行分析及加标回收率的测定(见表 2).根据磺胺药物的保留时间定性, 再根据各组分的峰面积用标准回归方程进行定量.实验结果表明, 鸡肉样品中有7个样品中未检测出, 3个样品检测出磺胺二甲氧基嘧啶(SDM), 含量为21.62~ 53.21 μ g/kg, 含量在我国对磺胺类残留的限度之内.同时, 对鸡肉样品进行的标准加入回收实验, 加标浓度为50 μ g/kg的回收率为85.2%~ 95.6%, 变异系数(relative standard deviation, RSD)为3.13%~ 4.33%(n=5), 结果表明鸡肉的基体对中空纤维膜微萃取测定磺胺类抗生素没有显著的影响.
| 表 2 6种抗生素的加标回收率及标准偏差 Tab.2 RSD and recovery of six sulfonamides |
本实验通过色谱条件的优化, 并经过检出限、精密度和回收率等方法学的考察, 探究了一种中空纤维膜液相微萃取-超高效液相色谱法测定鸡肉中6种磺胺类药物残留的方法.在最佳萃取条件下, 中空纤维膜微萃取对于这6种磺胺类的富集倍数可以达到188~ 950倍, 检出限为0.03~ 0.1 ng/mL (S/N=3), 显著提高了方法的灵敏度.而且中空纤维膜微萃取具有突出的样品净化功能, 有机试剂消耗少等优点, 适用于鸡肉产品中磺胺类药物残留的检测.
| [1] |
BARAN W, ADAMEK E, ZIEMIANSKA J, et al. Effects of the presence of sulfonamides in the environment and their influence on human health[J]. Journal of Hazardous Materials, 2011, 196: 1-15. DOI:10.1016/j.jhazmat.2011.08.082 |
| [2] |
彭英, 何欢, 孙成, 等. 新型固相微萃取-高效液相色谱测定牛奶中4种磺胺类药物残留[J]. 分析化学, 2013, 41(4): 529-533. |
| [3] |
田甜甜, 王瑞飞, 杨清香. 抗生素耐药基因在畜禽粪便-土壤系统中的分布、扩散及检测方法[J]. 微生物学通报, 2016(8): 1844-1853. |
| [4] |
DELAUNAY-BERTONCINI N, HENNION M C. Immunoaffinity solid-phase extraction for pharmaceutical and biomedical trace-analysis-coupling with HPLC and CE-perspectives[J]. Journal of Pharmaceutical and Biomedical Analysis, 2004, 34(4): 717-736. DOI:10.1016/S0731-7085(03)00559-4 |
| [5] |
SENYUVA H Z, GILBERT J. Immunoaffinity column clean-up techniques in food analysis:A review[J]. Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences, 2010, 878(2): 115-132. DOI:10.1016/j.jchromb.2009.05.042 |
| [6] |
罗成江, 陈慧华, 林仙军, 等. UPLC和HPLC法检测猪肉中磺胺类药物残留的比较[J]. 中国兽药杂志, 2012, 46(4): 25-28. |
| [7] |
BALAKRISHNAN V K, TERRY K A, TOITO J. Determination of sulfonamide antibiotics in wastewater:A comparison of solid phase microextraction and solid phase extraction methods[J]. Journal of Chromatography A, 2006, 1131(1-2): 1-10. DOI:10.1016/j.chroma.2006.07.011 |
| [8] |
冉丹, 郭靓, 李绍波, 等. 超声波辅助萃取-高效液相色谱法测定食品中碱性玫瑰精[J]. 分析试验室, 2011, 30(8): 108-111. DOI:10.3969/j.issn.1000-0720.2011.08.027 |
| [9] |
MCCLURE E L, WONG C S. Solid phase microextraction of macrolide, trimethoprim, and sulfonamide antibiotics in wastewaters[J]. Journal of Chromatography A, 2007, 1169(1/2): 53-62. |
| [10] |
林珊珊, 岳振峰, 张毅, 等. 微波辅助中空纤维膜液相微萃取-液相色谱-串联质谱法同时快速测定牛奶中27种抗生素残留[J]. 分析化学, 2013, 41(10): 1511-1517. |
| [11] |
MEI M, HUANG X J, LUO Q, YUAN D X, et al. Magnetism-enhanced monolith-based in-tube solid phase microextraction[J]. Anal Chem, 2016, 88(3): 1900-1907. DOI:10.1021/acs.analchem.5b04328 |
| [12] |
朱莉萍, 朱涛, 马运平, 等. 中空纤维膜液相微萃取-气相色谱质谱法快速测定蔬菜汁中15种邻苯二甲酸酯[J]. 分析化学, 2013, 41(7): 1019-1024. |
| [13] |
TAO Y, LIU J F, HU X L, et al. Hollow fiber supported ionic liquid membrane microextraction for determination of sulfonamides in environmental water samples by high-performance liquid chromatography[J]. Journal of Chromatography A, 2009, 1216(35): 6259-6266. DOI:10.1016/j.chroma.2009.06.025 |
| [14] |
PEDERSEN-BJERGAARD S, RASMUSSEN K E. Liquid-liquid-liquid microextraction for sample preparation of biological fluids prior to capillary electrophoresis[J]. Analytical Chemistry, 1999, 71(14): 2650-2656. DOI:10.1021/ac990055n |
| [15] |
王樊, 何蔓, 陈贝贝, 等. 二氧化钛涂覆中空纤维膜微萃取-电热蒸发-电感耦合等离子体质谱分析环境样品中痕量重金属[J]. 分析化学, 2015(9): 1313-1321. |




